题目内容
13.已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热为△H=-110.5 kJ/mol | |
| B. | 1molC(s)所具有的能量一定高于1molCO(g)所具有的能量 | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量 |
分析 A、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物以此解答;
B、根据反应知,1molC与1/2mol氧气具有的总能量一定高于1molCO具有的总能量;
C、在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热;
D、强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,弱电解质存在电离平衡,电离过程是吸热过程.
解答 解:A、碳的燃烧热是指1mol碳完全燃烧生成的稳定的氧化物CO2放出的热量,从2C(s)+O2(g)=2CO(g)△H=-221kJ/mol可知1mol碳燃烧生成CO放出110.5 kJ,碳的燃烧热大于110.5 kJ/mol,故A错误;
B、根据反应知,1molC与1/2mol氧气具有的总能量一定高于1molCO具有的总能量,故B错误;
C、稀硫酸和稀NaOH,为强酸和强碱,反应生成1mol水,放出的热量为57.3kJ,△H=-57.3 kJ/mol,故C正确;
D、稀醋酸与稀NaOH溶液混合,稀醋酸是弱电解质存在电离平衡,电离过程是吸热过程,所以△H<-57.3 kJ/mol,故D错误;
故选C.
点评 本题考查了燃烧热、中和热的概念分析理解,掌握热化学方程式的意义是解答本题的关键,题目较简单.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
4.用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
计算纯度:烧碱样品的纯度是80.8%(取两次实验所耗盐酸的平均值进行计算,不写计算过程)
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
1.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分,也可用来制备多种铁的化合物.回答下列问题:
(1)实验室以绿矾为原料,通过以下过程制备磁性Fe3O4胶体粒子:
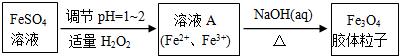
①写出FeSO4溶液转化为溶液A发生反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O.
②Fe3O4胶体粒子不能用过滤法实现分离,理由是胶体粒子的直径较小(在10-7~10-9m),过滤时可透过滤纸.
③一定条件下,Fe3+水解生成聚合物的离子方程式为:xFe3++yH2O?Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法有abd(填字母).
a.加水稀释 b.加入少量NaCl溶液
c.降温 d.加入少量Na2CO3固体
④设计一个实验,证明溶液A中既含有Fe3+又含有Fe2+:取少量溶液A于洁净的试管中,加入硫氰化钾溶液,溶液显红色,说明溶液中含有Fe3+;另取少量溶液A于另一洁净的试管中,滴入酸性高锰酸钾溶液,振荡后溶液颜色从紫红色变成黄色说明溶液含有Fe2+.
(2)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了Fe2+生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
①制备FeCO3时,将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中,目的是避免生成Fe(OH)2沉淀.
②将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌充分反应.反应结束后,无需过滤,再加入适量的柠檬酸溶液即可除去过量铁粉.该反应的化学方程式为Fe+C6H8O7=FeC6H6O7+H2↑.
③上述溶液经浓缩后,加入适量无水乙醇,静置、过滤、洗涤、干燥,得到柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(3)正常人每天应补充13.0mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天需服用含64.5mg FeSO4•7H2O的片剂(保留一位小数).
(1)实验室以绿矾为原料,通过以下过程制备磁性Fe3O4胶体粒子:
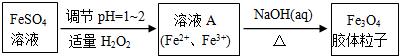
①写出FeSO4溶液转化为溶液A发生反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O.
②Fe3O4胶体粒子不能用过滤法实现分离,理由是胶体粒子的直径较小(在10-7~10-9m),过滤时可透过滤纸.
③一定条件下,Fe3+水解生成聚合物的离子方程式为:xFe3++yH2O?Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法有abd(填字母).
a.加水稀释 b.加入少量NaCl溶液
c.降温 d.加入少量Na2CO3固体
④设计一个实验,证明溶液A中既含有Fe3+又含有Fe2+:取少量溶液A于洁净的试管中,加入硫氰化钾溶液,溶液显红色,说明溶液中含有Fe3+;另取少量溶液A于另一洁净的试管中,滴入酸性高锰酸钾溶液,振荡后溶液颜色从紫红色变成黄色说明溶液含有Fe2+.
(2)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了Fe2+生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
②将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌充分反应.反应结束后,无需过滤,再加入适量的柠檬酸溶液即可除去过量铁粉.该反应的化学方程式为Fe+C6H8O7=FeC6H6O7+H2↑.
③上述溶液经浓缩后,加入适量无水乙醇,静置、过滤、洗涤、干燥,得到柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(3)正常人每天应补充13.0mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天需服用含64.5mg FeSO4•7H2O的片剂(保留一位小数).
5.六氟化硫分子呈正八面体(如图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是( )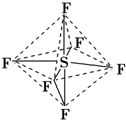

| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |
2. TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水电解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$在2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能转化为化学能 | |
| B. | 铂电极上发生的反应为:H2-2e-=2H+ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
3.铋(Bi)的两种同位素原子分别为:${\;}_{83}^{209}$Bi与${\;}_{83}^{210}$Bi,下列说法中正确的是( )
| A. | ${\;}_{83}^{209}$Bi比${\;}_{83}^{210}$Bi的质量数小1 | |
| B. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi都含有83个中子 | |
| C. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi的核外电子数不同 | |
| D. | ${\;}_{83}^{209}$Bi和${\;}_{83}^{210}$Bi分别含有126和127个质子 |
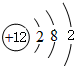 、
、 ,C的离子结构示意图
,C的离子结构示意图
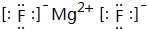 化学键类型为离子键.
化学键类型为离子键.