题目内容
9.下列物质:①H2O ②石墨 ③NH4NO3 ④AgCl ⑤CH3COOH⑥硫酸 ⑦NH3•H2O ⑧蔗糖,
其中属于强电解质的是③④⑥;属于弱电解质的是①⑤⑦;属于非电解质的是⑧(用编号填写)
分析 电解质在水溶液中或熔融状态下能够导电的化合物;非电解质在熔融状态和水溶液中都不能导电的化合物;
在水溶液中完全电离的是强电解质,部分电离的是弱电解质,据此分析.
解答 解:①H2O部分电离,是弱电解质;
②石墨是单质,既不是电解质也不是非电解质;
③NH4NO3在水溶液中完全电离,是强电解质;
④AgCl在熔融状态下能完全电离,故为电解质,且为强电解质;
⑤CH3COOH在水溶液中部分电离,是弱电解质;
⑥硫酸在水溶液中完全电离,是强电解质;
⑦NH3•H2O在水溶液中能部分电离,是电解质且为弱电解质;
⑧蔗糖在熔融状态和水溶液中都不能导电,是非电解质;
故为强电解质的是③④⑥,弱电解质为①⑤⑦,非电解质的为⑧.
故答案为:③④⑥;①⑤⑦;⑧.
点评 本题考查强弱电解质、非电解质概念的辨析,以及杂质的去除,难度中等.要注意除杂时,不能引入新的杂质.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.下列反应属于氧化还原反应的是( )
| A. | HCl+NaOH═NaCl+H2O | B. | SO3+H2O═H2SO4 | ||
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
4.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化钠与盐酸;氢氧化铜与盐酸 | B. | BaCl2与Na2SO4;Ba(OH)2与H2SO4 | ||
| C. | Na2CO3与硝酸;CaCO3与硝酸 | D. | 石灰石与硝酸反应;石灰石与盐酸 |
14.下列有关Na2CO3和NaHCO3的说法不正确的是( )
| A. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3产生的CO2多 | |
| B. | 等物质的量的盐酸分别与足量的Na2CO3和NaHCO3反应,Na2CO3产生的CO2多 | |
| C. | 相同温度在水中的溶解度:Na2CO3大于NaHCO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,消耗盐酸的量一样多 |
19.下列热化学方程式中的△H能表示物质燃烧热的是( )
| A. | 2CO (g )+O2(g )═2CO2 (g )△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l )△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l )△H=-571.6kJ•mol-1 | |
| D. | H2(g )+Cl2 (g )═2HCl (g)△H=-184.6kJ•mol-1 |
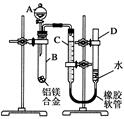 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.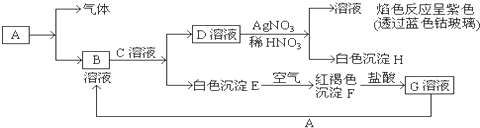

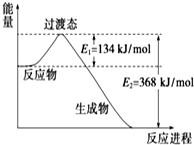 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234KJ/mol.