题目内容
20.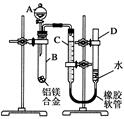 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.(已知仪器A中的试剂为足量)
若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),且B中剩余固体的质量为c g,则
(1)A中试剂为NaOH溶液(填化学式).
(2)B中发生反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)铝的相对原子质量为$\frac{33600(a-c)}{b}$.
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将偏小(填“偏大”、“偏小”或“不受影响”).
分析 测定铝镁合金中铝的质量分数和铝的相对原子质量,因Mg与NaOH不反应,而Al与Na反应,由实验可知,A中为NaOH溶液,B中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D为量气装置,B中剩余固体为Mg,固体质量差为Al的质量,利用氢气的体积可计算铝的质量分数和铝的相对原子质量.
解答 解:Mg与NaOH不反应,而Al与Na反应,由实验可知,A中为NaOH溶液,B中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,C、D为量气装置,
(1)由上述分析可知,A为NaOH溶液,故答案为:NaOH溶液;
(2)B中发生反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)B中剩余固体的质量为c g,为Mg的质量,则Al的质量为(a-c)g,则铝的质量分数为$\frac{(a-c)}{a}$×100%;
测得氢气体积为b mL,其物质的量为$\frac{b×1{0}^{-3}L}{22.4L/mol}$,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,Al的物质的量为$\frac{b×1{0}^{-3}L}{22.4L/mol}$×$\frac{2}{3}$=$\frac{b}{33600}$mol,则Al的摩尔质量为$\frac{(a-c)g}{\frac{b}{33600}mol}$=$\frac{33600(a-c)}{b}$g/mol,所以铝的相对原子质量为$\frac{33600(a-c)}{b}$,
故答案为:$\frac{33600(a-c)}{b}$;
(4)若未洗涤过滤所得的不溶物,c值偏大,则造成(a-c)变小,由铝的质量分数为$\frac{(a-c)}{a}$×100%可知,实验过程中铝的质量分数偏小,
故答案为:偏小.
点评 本题考查物质含量的测定,为高频考点,涉及Al的化学性质、化学反应方程式的计算等,综合性较强,侧重分析、实验与计算能力的考查,题目难度中等.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 反应的还原产物是N2 | |
| B. | 消耗1 mol氧化剂,转移电子3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).
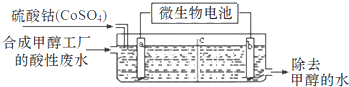
①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |