题目内容
15.下列反应属于氧化还原反应的是( )| A. | HCl+NaOH═NaCl+H2O | B. | SO3+H2O═H2SO4 | ||
| C. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
分析 含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A、B、D中均不含元素的化合价变化,均为非氧化还原反应,只有C中Na元素的化合价升高,Cl元素的化合价降低,为氧化还原反应,
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
5.下列反应水解方程式正确的是( )
| A. | AlCl3+3H2O═Al(OH)3+3HCl | |
| B. | Na2CO3+2H2O?H2CO3+2NaOH | |
| C. | 碳酸氢钠溶液:HCO3-+H2O?H2CO3+OH-- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+. |
6.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断正确的是( )
| A. | 反应的还原产物是N2 | |
| B. | 消耗1 mol氧化剂,转移电子3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
10.所含分子数相同的一组物质是( )
| A. | 10g H2和10g N2 | B. | 1mol H2O和1g H2O | ||
| C. | 3.2g O2和2.24L的空气 | D. | 22gCO2和3.01×1023个O2 |
20.下列物质中,属于电解质的是( )
| A. | NaCl溶液 | B. | 蔗糖 | C. | BaSO4 | D. | 铜 |
7. 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
8.工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
根据表中数据计算:
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).
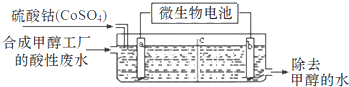
①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.