题目内容
17.已知有以下物质相互转化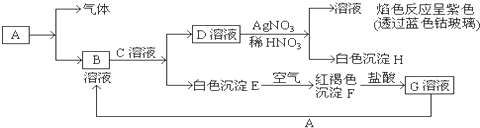
试回答:(1)写出B的化学式FeCl2C的化学式KOHD的化学式KCl.
(2)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(3)把KSCN加到G溶液中的现象是溶液呈现血红色; 向G溶液加入A的有关离子反应方程式Fe+2Fe3+=3Fe2+.
(4)焰色反应是物理(填物理或化学)变化,经过焰色反应试验后的铂丝可选择下面B (填字母)试剂清洗.
A 硫酸 B 盐酸 C 硝酸.
分析 依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe,结合对应物质的性质和题目要求解答该题.
解答 解:依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe,
(1)依据推断可知B的化学式为:FeCl2,C的化学式为:KOH,D的化学式为:KCl;
故答案为:FeCl2;KOH;KCl;
(2)E(Fe(OH)2)转变成F(Fe(OH)3)的反应是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)G为FeCl3,把KSCN加到G溶液中的现象是溶液呈现血红色,A为Fe,向G溶液加入A的有关离子反应方程式为Fe+2Fe3+=3Fe2+,
故答案为:溶液呈现血红色;Fe+2Fe3+=3Fe2+;
(4)焰色反应是 物理变化,经过焰色反应试验后的铂丝可在盐酸中清洗,故选B,
故答案为:物理;B.
点评 本题考查了无机物的推断,为高考常见题型,侧重于学生的分析能力和物质性质的应用,主要考查反应现象的判断应用,铁及其化合物的性质应用,现象分析是解题关键,难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
8.工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
根据表中数据计算:
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).
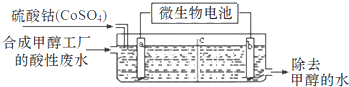
①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
(1)制取H2和CO通常采用:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是ad.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)?C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)?2CO(g)△H1;CO(g)+H2O(g)?H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
12.200mL0.1mol•L-1的Na2SO4溶液中,Na+的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
2.下列变化中生成物的总能量高于反应物的总能量的是( )
| A. | 碳酸钙受热分解 | B. | 铝粉与氧化铁粉末反应 | ||
| C. | 乙醇燃烧 | D. | 氧化钙与水反应 |
6.下列与NaHSO3溶液有关的离子方程式书写错误的是( )
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
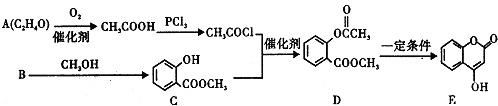
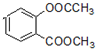 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O. ;
;