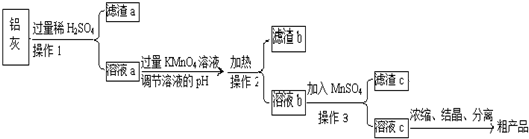
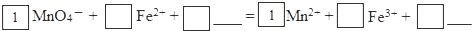题目内容
等质量的O2和O3中( )
| A、所含原子数相同 |
| B、所含分子数相同 |
| C、同温同压下,气体体积相同 |
| D、同温同压下,气体的密度相同 |
考点:阿伏加德罗定律及推论
专题:
分析:等质量的O2和O3,根据n=
知,相同质量时其物质的量之比等于摩尔质量反比=48g/mol:32g/mol=3:2,
A.二者组成元素相同,元素摩尔质量相同,其原子个数相等;
B.根据N=nNA知,分子数之比等于物质的量之比;
C.同温同压下,气体摩尔体积相等,根据V=nVm知,体积之比等于物质的量之比;
D.同温同压下,气体摩尔体积相等,根据ρ=
知,其密度之比等于摩尔质量之比.
| m |
| M |
A.二者组成元素相同,元素摩尔质量相同,其原子个数相等;
B.根据N=nNA知,分子数之比等于物质的量之比;
C.同温同压下,气体摩尔体积相等,根据V=nVm知,体积之比等于物质的量之比;
D.同温同压下,气体摩尔体积相等,根据ρ=
| M |
| Vm |
解答:
解:等质量的O2和O3,根据n=
知,相同质量时其物质的量之比等于摩尔质量反比=48g/mol:32g/mol=3:2,
A.二者组成元素相同,元素摩尔质量相同,所以其原子个数相等,故A正确;
B.根据N=nNA知,分子数之比等于物质的量之比=3:2,故B错误;
C.同温同压下,气体摩尔体积相等,根据V=nVm知,体积之比等于物质的量之比=3:2,故C错误;
D.同温同压下,气体摩尔体积相等,根据ρ=
知,其密度之比等于摩尔质量之比=32g/mol:48g/mol=2:3,故D错误;
故选A.
| m |
| M |
A.二者组成元素相同,元素摩尔质量相同,所以其原子个数相等,故A正确;
B.根据N=nNA知,分子数之比等于物质的量之比=3:2,故B错误;
C.同温同压下,气体摩尔体积相等,根据V=nVm知,体积之比等于物质的量之比=3:2,故C错误;
D.同温同压下,气体摩尔体积相等,根据ρ=
| M |
| Vm |
故选A.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量有关公式,难点是密度与摩尔质量关系的推导,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
| A、已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |||
| D、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
在同温同压下,两个容积相同的集气瓶,一个充满乙烯(C2H4),另一个充满甲烷(CH4)和丙炔(C3H4)的混合气体,这两瓶一定具有相同的( )
| A、碳原子数 | B、氢原子数 |
| C、质量 | D、密度 |
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、常温常压下,3.36L氯气与2.7g铝充分反应转移的电子数小于0.3NA |
| B、标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、80g CuO和Cu2S的混合物含有铜原子数一定为NA |
下列离子方程式正确的是( )
| A、氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| B、碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
下列解释事实的方程式不正确的是( )
| A、测0.1 mol/L氨水的pH为11:NH3?H2O?NH4++OH- | ||||
B、用CuCl2溶液做导电实验,灯泡发光:CuCl2
| ||||
| C、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+?2Mn2++5O2↑+8H2O | ||||
| D、铅酸蓄电池的正极在充电时的反应:PbSO4+2H2O-2e-?PbO2+4H++SO42- |