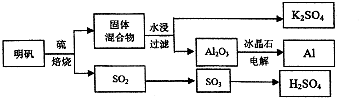
题目内容
用含有A12O3、SiO2和少量FeO?xFe2O3的铝灰制备A12(SO4)3?18H2O,工艺流程如下(部分操作和条件略):
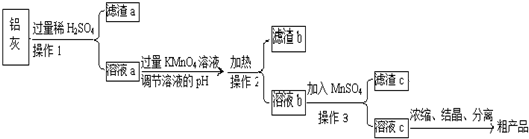
(1)滤渣a可用于制造 .
(2)请将MnO4-氧化Fe2+的离子方程式补充完整: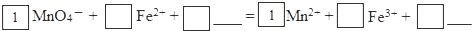
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol.
(3)已知生成氢氧化物沉淀的pH如下:
调节溶液pH约为3的目的是: .
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 .请写出加入MnSO4时所发生反应的离子方程式: .
(5)A12(SO4)3?18H2O溶于水溶液呈酸性的原因: .(用离子方程式表示)

(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
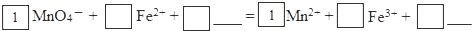
若反应中转移了2mol电子,则消耗氧化剂的物质的量为
(3)已知生成氢氧化物沉淀的pH如下:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是
(5)A12(SO4)3?18H2O溶于水溶液呈酸性的原因:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:含有A12O3、SiO2和少量FeO?xFe2O3的铝灰加过量稀硫酸溶解,A12O3、FeO?xFe2O3与硫酸反应生成硫酸铝、硫酸亚铁、硫酸铁的混合溶液,过滤得滤渣a为二氧化硅,滤液a加过量KMnO4溶液,将二价铁氧化成三价铁,再调节溶液的pH使三价铁沉淀,而铝离子不沉淀,操作2再过滤的滤渣b为氢氧化铁沉淀,滤液b主要含三价铝离子和过量的高锰酸根,再加入硫酸锰还原过量的高锰酸根,操作3再过滤得到滤液c,再蒸发浓缩、冷却结晶、过滤得到粗产品,以此分析解答;
(1)根据以上分析,滤渣a为二氧化硅,主要用作制作光导纤维;
(2)MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,结合电子、电荷守恒及原子守恒分析;
(3)调节溶液的pH约为3,由表格数据可知,铁离子完全转化为沉淀;
(4)根据取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体即氧气,所以滤渣C主要是二氧化锰催化双氧水分解生成氧气;IV中加入MnSO4,与MnO4-发生氧化还原反应生成二氧化锰.
(5)根据铝离子水解反应分析书写;
(1)根据以上分析,滤渣a为二氧化硅,主要用作制作光导纤维;
(2)MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,结合电子、电荷守恒及原子守恒分析;
(3)调节溶液的pH约为3,由表格数据可知,铁离子完全转化为沉淀;
(4)根据取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体即氧气,所以滤渣C主要是二氧化锰催化双氧水分解生成氧气;IV中加入MnSO4,与MnO4-发生氧化还原反应生成二氧化锰.
(5)根据铝离子水解反应分析书写;
解答:
解:含有A12O3、SiO2和少量FeO?xFe2O3的铝灰加过量稀硫酸溶解,A12O3、FeO?xFe2O3与硫酸反应生成硫酸铝、硫酸亚铁、硫酸铁的混合溶液,过滤得滤渣a为二氧化硅,滤液a加过量KMnO4溶液,将二价铁氧化成三价铁,再调节溶液的pH使三价铁沉淀,而铝离子不沉淀,操作2再过滤的滤渣b为氢氧化铁沉淀,滤液b主要含三价铝离子和过量的高锰酸根,再加入硫酸锰还原过量的高锰酸根,操作3再过滤得到滤液c,再蒸发浓缩、冷却结晶、过滤得到粗产品;
(1)根据以上分析,滤渣a为二氧化硅,主要用作制作光导纤维,故答案为:光导纤维;
(2)MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价为氧化剂,Fe元素的化合价由+2价升高为+3价为还原剂,由电子、电荷守恒及原子守恒可知,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,若反应中转移了2mol电子,则消耗氧化剂的物质的量为
=0.4mol,故答案为:5;8H+;5;4H2O;0.4mol;
(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液PH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(4)根据取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体即氧气,所以滤渣C主要是二氧化锰催化双氧水分解生成氧气;IV中加入MnSO4,与MnO4-发生氧化还原反应生成二氧化锰,发生的离子方程式为:2 MnO4-+3Mn2++2H2O═5MnO2+4 H+,故答案为:MnO2;2 MnO4-+3Mn2++2H2O═5MnO2+4 H+;
(5)A12(SO4)3?18H2O溶于水溶液呈酸性的原因铝离子水解反应生成氢离子,离子方程式为:Al3++3H2O?Al(OH)3+3 H+,
故答案为:Al3++3H2O?Al(OH)3+3 H+;
(1)根据以上分析,滤渣a为二氧化硅,主要用作制作光导纤维,故答案为:光导纤维;
(2)MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价为氧化剂,Fe元素的化合价由+2价升高为+3价为还原剂,由电子、电荷守恒及原子守恒可知,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,若反应中转移了2mol电子,则消耗氧化剂的物质的量为
| 2 |
| 5 |
(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液PH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(4)根据取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体即氧气,所以滤渣C主要是二氧化锰催化双氧水分解生成氧气;IV中加入MnSO4,与MnO4-发生氧化还原反应生成二氧化锰,发生的离子方程式为:2 MnO4-+3Mn2++2H2O═5MnO2+4 H+,故答案为:MnO2;2 MnO4-+3Mn2++2H2O═5MnO2+4 H+;
(5)A12(SO4)3?18H2O溶于水溶液呈酸性的原因铝离子水解反应生成氢离子,离子方程式为:Al3++3H2O?Al(OH)3+3 H+,
故答案为:Al3++3H2O?Al(OH)3+3 H+;
点评:本题考查较综合,涉及离子反应方程式的书写、沉淀生成及氧化还原反应,为高频考点,把握习题中的信息为解答的关键,侧重氧化还原反应及信息处理能力的考查,题目难度不大.

练习册系列答案
相关题目
等质量的O2和O3中( )
| A、所含原子数相同 |
| B、所含分子数相同 |
| C、同温同压下,气体体积相同 |
| D、同温同压下,气体的密度相同 |
下列反应中不属于基本反应类型的是( )
| A、Cl2+H2O═HCl+HClO |
| B、Zn+H2SO4═ZnSO4+H2↑ |
| C、Na2O+H2O═2NaOH |
| D、NaCl+AgNO3═AgCl↓+NaNO3 |
 普拉西坦(如图)是一种能改善记忆、抗健忘的中枢神经药.下列关于普拉西坦的说法不正确的是( )
普拉西坦(如图)是一种能改善记忆、抗健忘的中枢神经药.下列关于普拉西坦的说法不正确的是( )| A、一氯取代物有3种 |
| B、二氯取代物有9种 |
| C、可发生水解反应 |
| D、该物质中有羰基 |