题目内容
11.A1 和A2 是两种一元酸,它们的摩尔浓度c1<c2,电离度a1<a2,溶液的pH值pH1<pH2,则两种酸( )| A. | 都是强酸 | B. | 都是弱酸 | ||
| C. | a1 是强酸,a2 是弱酸 | D. | a1 是弱酸,a2 是强酸 |
分析 因都是一元弱酸,则由pH可知酸电离生成的氢离子的浓度,由电离度可知电离的程度,再利用浓度与电离度的关系来分析解答.
解答 解:已知pH1<pH2,则酸2电离生成的氢离子的浓度小,则c1×α1>c2×α2,而它们的摩尔浓度c1<c2,α1<α2,则酸1的电离程度小,
则都是强酸和弱酸都可使上式成立,故选AB.
点评 本题较难理解,考查学生对酸的电离及电离度的分析,明确cα=c(H+)是解答本题的关键,注意讨论来分析解答问题.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19. 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有1000ml容量瓶、玻璃棒.
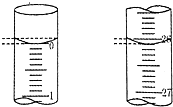
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数26.10mL.
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
则该氢氧化钠溶液的物质的量浓度c(NaOH)=0.1044mol/L.(保留三位有效数字)
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将偏低.(选填“偏高”、“偏低”或“无影响”)
 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有1000ml容量瓶、玻璃棒.
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数26.10mL.
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将偏低.(选填“偏高”、“偏低”或“无影响”)
6. 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用待装液润洗.
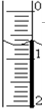
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面.如果页面初始位置如图所示,则此时的读数为0.70mL.
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察b(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
(4)请填写1组反应消耗的氢氧化钠溶液体积.
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是16.00mL.若
NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为0.1088mol/L.
(6)在本实验过程中,下列操作不会造成实验误差的是a(选填编号).
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定.
 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用待装液润洗.
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面.如果页面初始位置如图所示,则此时的读数为0.70mL.
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察b(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
| 实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
| 初读数 | 末读数 | 消耗体积 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是16.00mL.若
NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为0.1088mol/L.
(6)在本实验过程中,下列操作不会造成实验误差的是a(选填编号).
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定.
16. 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
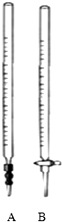
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
(5)判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.
3.如果慢慢加热蒸干并灼烧下列溶液,可以得到该溶液溶质固体的是( )
| A. | 高锰酸钾 | B. | 亚硫酸钠 | C. | 硝酸铝 | D. | 碳酸钾 |
20.下列说法中正确的是( )
| A. | 电子云通常是用小黑点来表示电子的多少 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 处于最低能量的原子叫基态原子 | |
| D. | 电子仅在激发态跃迁到基态时才会产生原子光谱 |
1. 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )
 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的獐抗炎退烧药,其结构如图所示.下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O2 | B. | 布洛芬与苯丙酸互为同系物 | ||
| C. | 丁苯丙酸共有12种可能的结构 | D. | 布洛芬能发生加成、取代等反应 |