题目内容
18.按如下装置图进行实验,回答下列问题: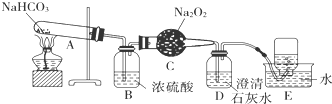
(1)A中的现象是试管内壁有无色液滴;
(2)B中浓硫酸的作用是干燥气体(吸收H2O);
(3)C中发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)D中现象是石灰水变浑浊;反应的离子方程式是CO2+Ca2++2OH-=CaCO3↓+H2O;
(5)E中收集的气体主要是O2.
分析 碳酸氢钠分解生成二氧化碳和水,浓硫酸具有吸水性,可用于干燥二氧化碳气体,在C中二氧化碳和过氧化钠反应生成碳酸钠和氧气,二氧化碳通入澄清石灰水中发生反应生成碳酸钙沉淀,氧气不溶于水,可用排水法收集,
①碳酸氢钠受热分解生成碳酸钠、二氧化碳气体和水,据此判断反应现象;
②B中浓硫酸能够吸水水分,起到干燥作用;
③C中过氧化钠与二氧化碳反应生成碳酸钠和氧气,据此写出反应的方程式;
④根据二氧化碳和石灰水的性质分析;
⑤根据发生的反应判断可能剩余的气体分析.
解答 解:①碳酸氢钠受热分解生成碳酸钠、水及二氧化碳,则A中会看到试管内壁有无色液滴,
故答案为:试管内壁有无色液滴;
②浓硫酸有吸水性,所以能作干燥剂,二氧化碳和浓硫酸不反应,所以能用浓硫酸干燥二氧化碳,
故答案为:干燥气体(吸收H2O);
③二氧化碳和过氧化钠反应生成碳酸钠和氧气2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
④二氧化碳能使澄清的石灰水变浑浊,所以未与过氧化钠反应的二氧化碳使石灰水变浑浊,发生反应的离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:石灰水变浑浊;CO2+Ca2++2OH-=CaCO3↓+H2O;
⑤碳酸氢钠分解生成的水蒸汽被浓硫酸吸收,未与过氧化钠反应的二氧化碳被石灰水吸收,所以E中收集的气体就是二氧化碳和过氧化钠反应生成的O2,
故答案为:O2.
点评 本题考查了实验装置的综合应用,题目难度中等,明确是实验目的为解答关键,注意掌握碳酸氢钠、过氧化钠等物质的性质,试题充分培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
8.下列状态时,不能导电的电解质是( )
| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 稀硫酸 |
9.某些含羟基的药物具有苦味,如以下结构的氯霉素:此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的酯类 | B. | 它是棕榈酸的盐类 | ||
| C. | 它的水溶性变好,所以苦味消失 | D. | 该过程发生了中和反应 |
6.下列离子组能在溶液中大量共存的是( )
| A. | Mg2+、Fe3+、SO42-、I- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Na+、Fe3+、HCO3-、Cl- | D. | Mg2+、Fe3+、SO42-、Cl- |
13.氯气和水反应生成HCl和HClO,欲从反应混合物中分离出HClO溶液,下列方法可选用的是( )
| A. | 加硫酸钙,充分反应后蒸馏 | B. | 加碳酸钙,充分反应后蒸馏 | ||
| C. | 加磷酸钙,充分反应后蒸馏 | D. | 加氯化钙,充分反应后蒸馏 |
3.下列各组物质混合后,没有明显现象的是:①H2S和S02;②S02和SO3③SO2和氯水;④S03(气)和C12;⑤H2S和C12( )
| A. | ①③⑤ | B. | ②④ | C. | ②⑤ | D. | ③④⑤ |
1.在一定条件下,将N2和H2按体积比1:3混合充入某密闭容器中,发生反应:N2+3H2?2NH3.当反应在平衡时,恢复到原温度和压强下,测得NH3的体积分数为40%,则N2在平衡混合体系中的体积分数为( )
| A. | 15% | B. | 20% | C. | 30% | D. | 40% |
18.下列化工工艺可得到汽油的是( )
| A. | 干馏 | B. | 常压分馏 | C. | 裂解 | D. | 催化重整 |
19.下列四组溶液分别倒入四只烧杯中,并加蒸馏水稀释至50mL,其中NO${\;}_{3}^{-}$物质的量浓度最大的是( )
| A. | 30 mL 1 mol/L的KNO3溶液 | B. | 20 mL 0.5 mol/L的Ba(NO3)2溶液 | ||
| C. | 10 mL 0.6 mol/L的Mg(NO3)2溶液 | D. | 40 mL 0.3 mol/L的Fe(NO3)3溶液 |