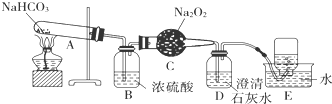
题目内容
8.下列状态时,不能导电的电解质是( )| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 稀硫酸 |
分析 电解质是指:在水溶液或熔化状态下能导电的化合物.对照各选项既要是化合物,又在水溶液或熔化状态下能导电,且无水溶液或熔融状态不能导电,据此判断即可.
解答 解:A、HCl在水溶液中能导电,故为电解质;但在液态时共价键不能断裂,无自由移动的离子,故不能导电,故A正确;
B、熔融状态的食盐能导电,但由于食盐是混合物,故既不是电解质也不是非电解质,故B错误;
C、硫酸铜溶液能导电,但由于是混合物,故既不是电解质也不是非电解质,故C错误;
D、稀硫酸能导电,但由于是混合物,故既不是电解质也不是非电解质,故D错误;
故选A.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件进行解题.

练习册系列答案
相关题目
18.铁及其化合物在日常生活、生产中应用广泛.
(1)在某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
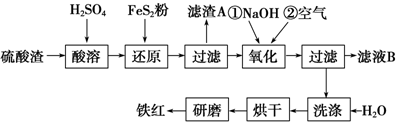
①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4.
请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO${\;}_{4}^{2-}$+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见上表).
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
(1)在某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为B(填字母).
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3发生反应的离子方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成分的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4.
请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO${\;}_{4}^{2-}$+16H+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
⑤滤液B可以回收的物质有ABD(填序号).
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4.
19.某元素的天然同位素有${\;}_{17}^{35}$A和${\;}_{17}^{37}$A,如果该元素的近似相对原子质量为35.5,则${\;}_{17}^{35}$A和${\;}_{17}^{37}$A的原子个数比为( )
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
3.如图所示实验操作中,不正确的是( )
| A. |  加热液体 | B. |  读取液体体积 | C. |  稀释浓硫酸 | D. |  点燃酒精灯 |
13. 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
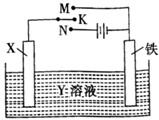
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1(1)已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol
②C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则 a=-28.5kJ.mol-1
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小 (填“增大“、“不变”或“减小”).
(3)在T0C时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按如表所示加人物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ab(填字母).
a.当容器内气体密度恒定时,表明反应达到平衡状态
b.甲容器中CO的平衡转化率小于乙容器中CO的平衡转化率
c.甲、乙容器中,CO的平衡浓度之比为3:2
d.增加Fe2O3的量可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.利用如图装置,可以模拟铁的电化学防护,其中Y为NaCl
①X为碳棒,为减缓铁的腐蚀,开关K应置N处(填字母).
②若X为锌,开关K置于M处,铁极发生的电极反应式为O2+2H2O+4e-=4OH-.
(5)高铁电池是一种新型可充电电捧,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性减弱.
20.下列有关元素存在及应用的说法正确的是( )
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 工业制硫酸、硝酸的关键步骤都应用了催化氧化的方法 | |
| C. | 水泥、玻璃、光导纤维都是硅酸盐产品 | |
| D. | 钠、铝、铁、硫、氯等元素在自然界中只有化合态存在 |
17. X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
电子数的3倍,下列说法中不正确的是( )
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层电子数的3倍,下列说法中不正确的是( )
| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |