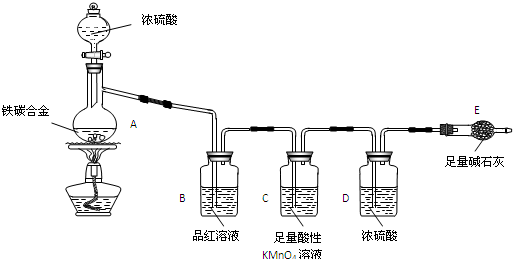
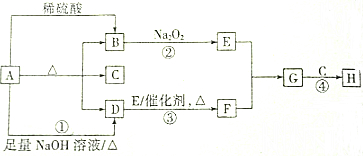
题目内容
3.下列有关盐类水解的说法中,正确的是( )| A. | 所有的盐在水溶液中都能水解 | |
| B. | 盐类水解一定都显酸性或碱性 | |
| C. | 盐类的水解反应是酸碱中和反应的逆反应,因此盐类水解是吸热反应 | |
| D. | 盐类水解抑制了水的电离 |
分析 A、盐中有弱离子才能水解;
B、弱酸弱碱盐水解可能显中性;
C、盐类的水解是酸碱中和的逆反应;
D、盐类水解是盐中的弱离子结合了水电离出的氢离子或氢氧根从而生成弱电解质的过程.
解答 解:A、盐中有弱离子才能水解,故强酸强碱盐不水解,故A错误;
B、弱酸弱碱盐水解可能显中性,如醋酸铵发生双水解,但溶液显中性,故B错误;
C、盐类的水解是酸碱中和的逆反应,酸碱中和反应为放热反应,故盐类水解吸热,故C正确;
D、盐类水解是盐中的弱离子结合了水电离出的氢离子或氢氧根从而生成弱电解质的过程,故盐类的水解对水的电离有促进作用,故D错误.
故选C.
点评 本题考查了盐类水解的条件以及显的酸碱性,记住盐类水解规律:有弱才水解,无弱不水解,谁弱谁水解,谁强显谁性.

练习册系列答案
相关题目
14.一定温度下,反应2NO+O2?2NO2在容积不变的密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 升高反应温度 | B. | 保持容积不变,充入NO2 | ||
| C. | 保持容积不变,充入He | D. | 保持压强不变,充入He |
11.运用元素周期律分析下列推断,其中错误的是( )
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
18.相同温度下,下列物质中导电性最强的是( )
| A. | 80ml 0.1 mol•L-1NaCl溶液 | B. | 50ml 0.1 mol•L-1MgSO4溶液 | ||
| C. | 100ml 0.1 mol•L-1氨水 | D. | 0.1 mol固体氯化钠 |
8.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
15.在从海带中提取碘的实验中,下列做法错误的是( )
| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
12. 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )| A. | A点时pH=1 | |
| B. | 恰好完全沉淀时Ba(OH)2溶液的体积为2L | |
| C. | B点时,溶液中的离子浓度关系为c(Na+)>c(SO42-)>c(H+)=c(OH-) | |
| D. | C点时pH=14 |