题目内容
14.一定温度下,反应2NO+O2?2NO2在容积不变的密闭容器中进行,下列措施不改变化学反应速率的是( )| A. | 升高反应温度 | B. | 保持容积不变,充入NO2 | ||
| C. | 保持容积不变,充入He | D. | 保持压强不变,充入He |
分析 根据影响化学反应速率的因素有浓度、温度、压强和催化剂等进行判断,注意压强的改变必须是浓度改变时,反应速率才能发生改变,以此解答.
解答 解:A.升高反应温度,活化分子数目增多,反应速率增大,故A不选;
B.保持容积不变,充入NO2,浓度增大,反应速率增大,故B不选;
C.保持容积不变,充入He,浓度不变,反应速率不变,故C选;
D.保持压强不变,充入He,体积增大,浓度减小,反应速率减小,故D不选.
故选C.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
4.下列各组物质发生的变化中,均属于化学变化的一组是( )
| A. | 鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀;一束平行光照射蛋白质溶液时,从侧面可以看到光亮的通路 | |
| B. | 块状生石灰在空气中逐渐变成粉末;Na2CO3•10H2O在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
5.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是( )
| 实验装置 | 部分实验现象 | 实验装置 | 部分实验现象 |
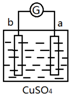 | a极质量减小, b极质量增加 | 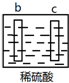 | b极有气体产生, c极无变化 |
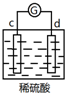 | d极溶解, c极有气体产生 | 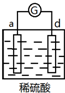 | 电流计指示在导线中电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
2.下列有关化学用语正确的是( )
| A. | CO2的结构式:O-C-O | B. | 羟基的电子式: | ||
| C. | NH3分子比例模型: | D. | Cl-的结构示意图: |
9.空气中SO2含量是重要的空气质量指标.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
(1)取25.00ml的烟道气的水溶液所用仪器名称是酸式滴定管
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,
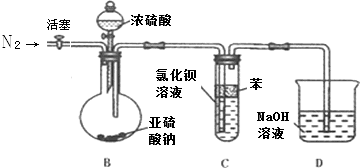
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,

请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
6.下列说法错误的是( )
| A. | 1H和3H是不同的核素 | |
| B. | 1H、2H、3H、H+和H2是氢元素的五种不同粒子 | |
| C. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 | |
| D. | 石墨和金刚石互为同位素,化学性质相似 |
3.下列有关盐类水解的说法中,正确的是( )
| A. | 所有的盐在水溶液中都能水解 | |
| B. | 盐类水解一定都显酸性或碱性 | |
| C. | 盐类的水解反应是酸碱中和反应的逆反应,因此盐类水解是吸热反应 | |
| D. | 盐类水解抑制了水的电离 |
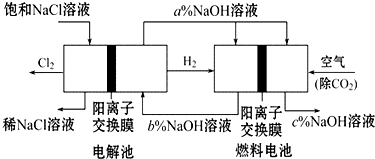 有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:
有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题: