题目内容
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
考点:化学实验方案的评价,乙烯的实验室制法,尾气处理装置,配制一定物质的量浓度的溶液
专题:实验评价题
分析:A.容量瓶不能稀释或溶解药品;
B.有缓冲装置的能防止倒吸;
C.在浓硫酸作催化剂、170℃条件下,乙醇发生消去反应生成乙烯,测量温度是溶液温度;
D.乙醇也能被酸性高锰酸钾溶液氧化.
B.有缓冲装置的能防止倒吸;
C.在浓硫酸作催化剂、170℃条件下,乙醇发生消去反应生成乙烯,测量温度是溶液温度;
D.乙醇也能被酸性高锰酸钾溶液氧化.
解答:
解:A.容量瓶不能稀释或溶解药品,只能配制溶液,故A错误;
B.四氯化碳和氨气不反应,且四氯化碳密度大于水,该装置中有缓冲作用,所以能防止倒吸,故B正确;
C.在浓硫酸作催化剂、170℃条件下,乙醇发生消去反应生成乙烯,测量温度是溶液温度而不是蒸气温度,蒸馏时测量温度是馏分温度,故C错误;
D.乙醇易挥发,所以制取的乙烯中含有乙醇,乙醇也能被酸性高锰酸钾溶液氧化,导致对乙烯造成干扰,故D错误;
故选B.
B.四氯化碳和氨气不反应,且四氯化碳密度大于水,该装置中有缓冲作用,所以能防止倒吸,故B正确;
C.在浓硫酸作催化剂、170℃条件下,乙醇发生消去反应生成乙烯,测量温度是溶液温度而不是蒸气温度,蒸馏时测量温度是馏分温度,故C错误;
D.乙醇易挥发,所以制取的乙烯中含有乙醇,乙醇也能被酸性高锰酸钾溶液氧化,导致对乙烯造成干扰,故D错误;
故选B.
点评:本题考查了实验方案评价,根据常见仪器的作用、防止倒吸的方法、物质的性质等知识点来分析解答,注意:乙烯的制取、蒸馏时温度计的位置,为易错点.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值下列叙述正确的是( )
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
用下列实验装置进行相应实验,能达到实验目的是( )
A、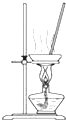 如图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
B、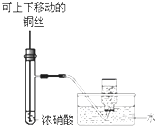 如图所示装置,制备并收集少量NO2气体 |
C、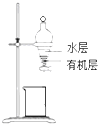 如图所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、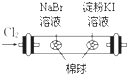 如图所示装置,可以证明氧化性:Cl2>Br2>I2 |
下列反应的离子方程式不正确的是( )
| A、铁和稀盐酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、硫酸溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
| D、在氢氧化钾的稀溶液中通过量的二氧化碳气体:CO2+OH-═HCO3- |