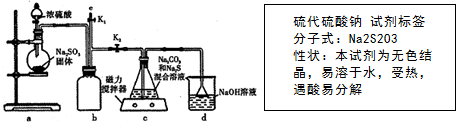
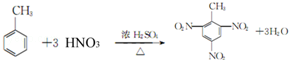
题目内容
7.下列反应的离子方程式正确的是( )| A. | 硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠溶液中加入足量盐酸:Na2CO3+2H+═Na++CO2↑+H2O | |
| D. | 氢氧化铝中和胃酸(盐酸):Al(OH)3+3H+═Al3++3H2O |
分析 A.硫酸铜为易溶物,离子方程式中硫酸铜应该拆开;
B.2mol钠与水完全反应生成1mol氢气,该反应不满足电子守恒、电荷守恒;
C.碳酸钠为易溶的强电解质,离子方程式中应该拆开;
D.氢氧化铝与盐酸反应生成氯化铝和水.
解答 解:A.硫酸铜与烧碱溶液反应中,硫酸铜需要拆开,正确的离子方程式为:Cu2++2OH-═Cu(OH)2↓,故A错误;
B.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.碳酸钠溶液中加入足量盐酸,碳酸钠需要拆开,正确的离子方程式为::CO32-+2H+═CO2↑+H2O,故C错误;
D.氢氧化铝中和胃酸(盐酸),反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
18.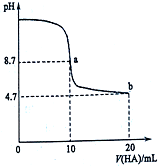 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
15.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子通过,下列有关叙述正确的是( )
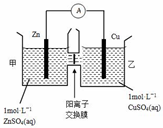

| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
19.某核素${\;}_{Z}^{A}X$可形成HmX型氢化物,则 a g HmX 含有( )
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
16.在某些工厂中常用高压电对气溶胶作用来除去大量的烟尘.以减少污染,这种做法所应用的原理是( )
| A. | 电泳 | B. | 胶体的聚沉 | C. | 布朗运动 | D. | 电解 |