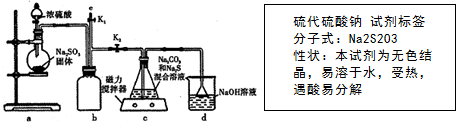
题目内容
6. 实验室要配制2mol/L稀硫酸250mL.
实验室要配制2mol/L稀硫酸250mL.(1)需要量取质量分数为98%密度为1.84g/mL的浓硫酸27.2 mL.
(2)配制过程中除了烧杯量筒,玻璃棒,还需要哪些仪器250mL容量瓶,胶头滴管
(3)容量瓶使用前应先检漏,请简述捡漏的操作方法向容量瓶中加水,塞紧玻璃塞,倒转容量瓶观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验
(4)下列实验操作中,按先后顺序排列为DCAEBFHG.
A.将稀释、冷却后的硫酸沿玻璃棒注入250mL容量瓶中.
B.将洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀.
C.将量取的浓硫酸沿玻璃棒缓慢注入烧杯中,搅拌并冷却至室温.
D.向烧杯中加入约100mL蒸馏水.
E.用适量蒸馏水洗涤烧杯2~3次.
F.向容量瓶中加蒸馏水到液面接近刻度1cm~2cm处.
G.盖上瓶塞,并反复倒转摇匀.
H.用胶头滴管加蒸馏水到瓶颈刻度处.
(5)由于错误操作,判断得到的实际浓度与理论数据的偏差(填偏大,偏小或无影响)
A、用量筒量取一定量液体时,俯视液面读数偏小
B、容量瓶刚用蒸馏水洗净,没有烘干无影响
(6)最后将所配溶液存放在试剂瓶中,并贴上标签,请你填写该标签(如图).
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(3)根据容量瓶的检漏方法回答,具体见解答;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;
(5)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏大或者使V偏小的操作,溶液浓度都偏高,反正溶液浓度偏低;
(6)标签上应注明药品名称的化学式和浓度.
解答 解:(1)质量分数为98%密度为1.84g/mL的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=2mol/L×250mL,解得V=27.2mL,故答案为:27.2;
(2)用浓硫酸配制稀硫酸步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器:50mL量筒、胶头滴管、烧杯、玻璃棒、250mL容量瓶;配制过程中除了烧杯量筒,玻璃棒,还需要哪些仪器250mL容量瓶,胶头滴管,
故答案为:250mL容量瓶,胶头滴管;
(3)容量瓶使用前应先检漏,捡漏的操作方法是:向容瓶中加水,塞紧玻璃塞,倒转容量瓶观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验,
故答案为:向容瓶中加水,塞紧玻璃塞,倒转容量瓶观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验;
(4)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,正确的顺序为:DCAEBFHG,
故答案为:DCAEBFHG;
(5)A.用量筒量取一定量液体时,俯视液面读数,实际量的浓硫酸体积变小,浓度偏低,故答案为:偏小;
B.容量瓶在配制溶液过程中还得加水,故刚用蒸馏水洗净,没有烘干无影响,故答案为:无影响;
(6)标签上应注明药品名称的化学式和浓度,故答案为:.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作过程是解题关键,注意容量瓶规格、量筒规格的选择,注意误差分析的方法和技巧.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| A. | 该一元醇也能与银氨溶液反应生成银 | |
| B. | 混合物中一定含有甲醛 | |
| C. | 混合物中醇与醛的物质的量之比为1:3 | |
| D. | 混合物中的一元醛是乙醛 |
| A. | 混合前pH(CH3COOH)+pH(NaOH)=14 | B. | 混合后c(Na+)=c(CH3COO3-)+c(OH-) | ||
| C. | 混合前c(CH3COOH)>c(NaOH) | D. | 混合后c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
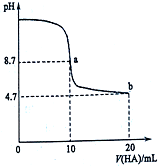 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
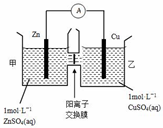
| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
| A. | 电泳 | B. | 胶体的聚沉 | C. | 布朗运动 | D. | 电解 |