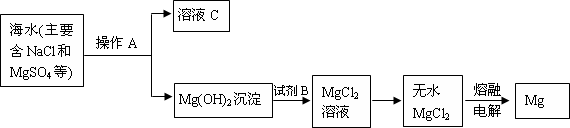
题目内容
现用质量分数为98%,密度为1.84g/cm3的浓硫酸来配制500ml 0.2mol/L的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤容量瓶 ⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有 .
(2)计算所需浓硫酸的体积为 .现有①10ml ②50ml ③100ml三种规格的量筒,最好选用 .(填代号)
(3)将浓硫酸加适量蒸馏水稀释后,冷却至室温,后转移到 mL容量瓶中,并用 引流.转移完毕后,将烧杯,玻璃棒洗涤 次,将洗涤液转移到容量瓶中,加水至液面距离刻度线 cm处,改用 滴加蒸馏水至溶液凹液面最低处恰好与刻度线相平,最后颠倒摇匀.
(4)在配制过程中,下列操作可引起所配溶液浓度偏高的有 .(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中.
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容量,俯视刻度线.
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤容量瓶 ⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有
(2)计算所需浓硫酸的体积为
(3)将浓硫酸加适量蒸馏水稀释后,冷却至室温,后转移到
(4)在配制过程中,下列操作可引起所配溶液浓度偏高的有
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中.
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容量,俯视刻度线.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析;
(4)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
(2)先计算出浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析;
(4)根据c=
| n |
| V |
解答:
解:(1)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:⑥⑦;
(2)浓硫酸的物质的量浓度c=
=18.4mol/L,设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=500ml×0.2mol/L,
解得V=5.4mL.则量筒选10mL,故答案为:5.4mL;①;
(3)操作步骤有计算、量取、稀释、移液、洗 涤移液、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故答案为:500;玻璃棒;2-3;1-2;胶头滴管;
(4)①洗涤量取浓硫酸的量筒,并将 洗涤液转移到定量瓶中,所取溶质的量偏多,会使所配溶液浓度偏高,故①选;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,定容时溶液温度高于室温,会使所配溶液浓度偏高,故②选;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故③不选;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致溶质有损失,会使所配溶液浓度偏低,故④不选;
⑤若定容时俯视刻度线,使溶液的体积偏低,所以溶液浓度偏高,故⑤选;
故选①②⑤.
(2)浓硫酸的物质的量浓度c=
| 1000ρω |
| M |
解得V=5.4mL.则量筒选10mL,故答案为:5.4mL;①;
(3)操作步骤有计算、量取、稀释、移液、洗 涤移液、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故答案为:500;玻璃棒;2-3;1-2;胶头滴管;
(4)①洗涤量取浓硫酸的量筒,并将 洗涤液转移到定量瓶中,所取溶质的量偏多,会使所配溶液浓度偏高,故①选;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,定容时溶液温度高于室温,会使所配溶液浓度偏高,故②选;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故③不选;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致溶质有损失,会使所配溶液浓度偏低,故④不选;
⑤若定容时俯视刻度线,使溶液的体积偏低,所以溶液浓度偏高,故⑤选;
故选①②⑤.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列有关的计算分析不正确的是( )
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
下面关于Na2CO3和NaHCO3性质的叙述,不正确的是( )
| A、在水中的溶解度:碳酸钠>碳酸氢钠 |
| B、热稳定性:碳酸钠>碳酸氢钠 |
| C、溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH |
| D、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
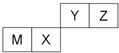

| A、Z位于元素周期表中第2周期、第ⅥA族 |
| B、原子半径Z<M |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、X的最简单气态氢化物的热稳定性比Z的小 |
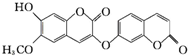 西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )
西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )| A、分子中所有原子可以处于同一平面 |
| B、该物质能发生加成、氧化、水解、消去等反应 |
| C、能与FeCl3溶液发生显色反应 |
| D、1 mol该有机物最多可与3 mol NaOH反应 |
关于常温下pH=3的醋酸溶液,下列叙述正确的是( )
| A、加水稀释10倍后,pH=4 |
| B、加水稀释后,溶液中c(H+)和c(OH-)均减少 |
| C、加入醋酸钠晶体后,溶液的pH增大 |
| D、加入等体积pH=11的NaOH溶液后,溶液呈中性 |