题目内容
在标准状态下,将1.40g N2、1.60g O2、4.00g Ar混合,该混合物气体体积是 ,该混合气体平均摩尔质量是 .
考点:阿伏加德罗定律及推论
专题:计算题
分析:根据n=
=
计算.
| m |
| M |
| V |
| Vm |
解答:
解:n(N2)
=0.05mol,n(O2)=
=0.05mol,n(Ar)=
=0.1mol,
气体总物质的量为0.05mol+0.05mol+0.1mol=0.2mol,
则总体积为0.2mol×22.4L/mol=4.48L,
M=
=35g/mol,
故答案为:4.48L;35g/mol.
| 1.40g |
| 28g/mol |
| 1.60g |
| 32g/mol |
| 4.00g |
| 40g/mol |
气体总物质的量为0.05mol+0.05mol+0.1mol=0.2mol,
则总体积为0.2mol×22.4L/mol=4.48L,
M=
| 1.40g+1.60g+4.00g |
| 0.2mol |
故答案为:4.48L;35g/mol.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,主要把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
一定温度下,在固定容积的密闭容器中充入2molA和1molB发生反应2A(g)+B(g)=3C(g),达到平衡后,C的体积分数为C%,在相同条件下,按下列情况充入物质达到平衡时,C的体积分数也为C%的是( )
| A、1molA 2molC |
| B、4mol C |
| C、2molA 3molC |
| D、1molA 1molB |
下列有关的计算分析不正确的是( )
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
镧系元素的水合氯化物LnCl3?nH2O,加热脱水时易发生分解,为了制无水LnCl3,可采用的措施是( )
| A、在HCl气流中加热使之脱水 |
| B、在NH3气流中加热使之脱水 |
| C、加入P2O5固体加热使之脱水 |
| D、加入H2SO4加热使之脱水 |
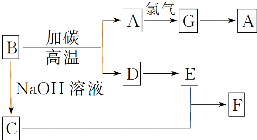 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.