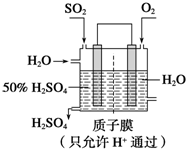
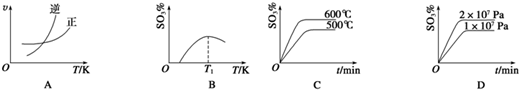
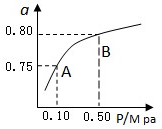
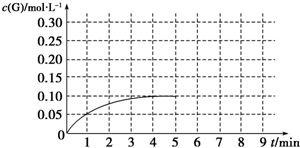
题目内容
某溶液能与锌片作用产生H2,则该溶液中可以大量共存的离子组是( )
| A、Na+、NO3-、K+、Fe2+ |
| B、Fe2+、Na+、SO42-、K+ |
| C、K+、I-、NO3-、H+ |
| D、NH4+、NO3-、Na+、HCO3- |
考点:离子共存问题
专题:离子反应专题
分析:能与锌片作用产生H2,溶液显酸性,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,则离子大量共存,以此来解答.
解答:
解:A.NO3-、H+、Fe2+发生氧化还原反应,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.I-、NO3-、H+发生氧化还原反应,不能大量共存,故C错误;
D.H+、HCO3-结合生成水和碳酸根离子,不能大量共存,故D错误;
故选B.
B.该组离子之间不反应,可大量共存,故B正确;
C.I-、NO3-、H+发生氧化还原反应,不能大量共存,故C错误;
D.H+、HCO3-结合生成水和碳酸根离子,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子的反应为解答的关键,侧重复分解、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
居室装修用石材的放射性常用
Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖.下列叙述中正确的是( )
226 88 |
| A、Ra元素位于元素周期表中第六周期ⅡA |
| B、RaSO4难溶于水和强酸 |
| C、RaCO3不能与盐酸反应 |
| D、Ra(OH)2是一种两性氢氧化物 |
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列关于常见有机物的说法中,不正确的是( )
| A、苯和乙烯都能与氢气发生加成反应 |
| B、淀粉和蛋白质都是人体重要的营养物质 |
| C、乙酸和乙醇都能与氢氧化钠溶液反应 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |