题目内容
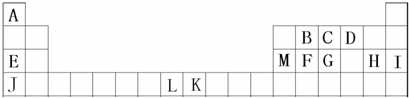
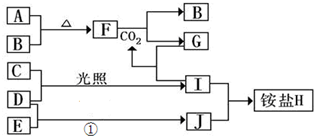
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应.
(1)单质E的结构式
(2)F和H2O反应的化学方程式为 ,该反应中被氧化与被还原的物质的物质的量之比是
(3)铵盐H中阳离子的电子式 ,检验H中阳离子的方法是 .

(1)单质E的结构式
(2)F和H2O反应的化学方程式为
(3)铵盐H中阳离子的电子式
考点:无机物的推断
专题:推断题
分析:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2,据此解答.
解答:
解:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2,
(1)单质E为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N,故答案为:N≡N;
(2)F为过氧化钠,与H2O反应生成氢氧化钠与氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中被氧化与被还原的物质都是过氧化钠,由电子转移守恒可知,被氧化与被还原过氧化钠的物质的量之比是1:1,故答案为:2Na2O2+2H2O=4NaOH+O2↑;1:1;
(3)铵盐H为NH4Cl,NH4+离子的电子式为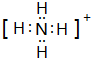 ,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为: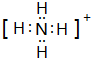 ;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
(1)单质E为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N,故答案为:N≡N;
(2)F为过氧化钠,与H2O反应生成氢氧化钠与氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中被氧化与被还原的物质都是过氧化钠,由电子转移守恒可知,被氧化与被还原过氧化钠的物质的量之比是1:1,故答案为:2Na2O2+2H2O=4NaOH+O2↑;1:1;
(3)铵盐H为NH4Cl,NH4+离子的电子式为
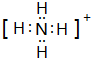 ,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,故答案为:
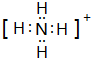 ;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
点评:本题考查无机物推断,涉及Na、Cl、N元素单质化合物性质,物质的状态、焰色反应及转化中特殊反应等是推断突破口,侧重基础知识的巩固,难度不大,注意中学常见化学工业.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、常温下,CH3COONa和CH3COOH混合溶液pH=7,且c(Na+)=0.1mol?L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、在0.1mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2mol?L-1 NaHCO3溶液中加入等体积0.1mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、在0.1mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
下列关于常见有机物的说法中,不正确的是( )
| A、苯和乙烯都能与氢气发生加成反应 |
| B、淀粉和蛋白质都是人体重要的营养物质 |
| C、乙酸和乙醇都能与氢氧化钠溶液反应 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
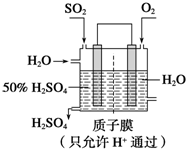
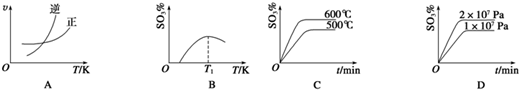
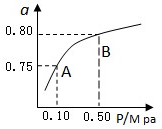
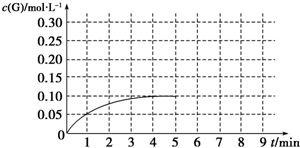
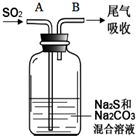 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.