题目内容
14.醛可发生分子间的反应,生成羟基醛,如:
现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
分析 由题目信息可知:3HCHO+CH3CHO→(HOCH2)3CCHO,(HOCH2)3CCHO再与氢气发生加成反应得到C(CH2OH)4.
解答 解:由题目信息可知:3HCHO+CH3CHO→(HOCH2)3CCHO,(HOCH2)3CCHO再与氢气发生加成反应得到C(CH2OH)4,故消耗的甲醛与乙醛的物质的量之比为3:1,
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力考查,注意信息中醛的加成反应应用,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
5.下列关于化学键的说法中不正确的是( )
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
9.下列叙述正确的是( )
| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
6.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍.则X、Y、Z三种元素,可能的组合是( )
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
3.下列实验设计能达到相应实验目的是( )
| 选项 | 实验设计 | 实验目的 |
| A | 在热的NaOH溶液中滴入饱和FeCl3溶液 | 制备Fe(OH)3胶体 |
| B | 将SO2通入KMnO4溶液 | 验证SO2的漂白性 |
| C | 向含少量Fe3+的MgCl2溶液中加入适量MgCO3粉末,加热、搅拌并过滤 | 除去MgCl2溶液中少量的Fe3+ |
| D | 将0.1mol•L-1的Na2SO4溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1的Na2CO3溶液 | 比较BaCO3与BaSO4溶度积的大小 |
| A. | A | B. | B | C. | C | D. | D |
4.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A. | 原子序数A>B | B. | 电子总数A->B2+ | C. | 离子半径A->B2+ | D. | 原子半径A>B |
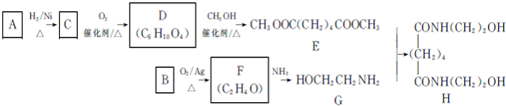
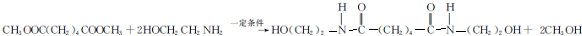 .
.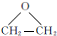 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.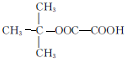 (写结构简式).
(写结构简式).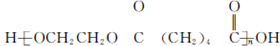 的合成路线:
的合成路线: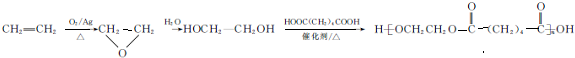 .
.