题目内容
16.在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题: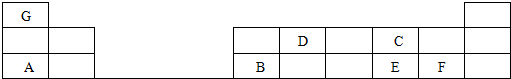
(1)D的元素名称为碳;
(2)G和F形成化合物的电子式为
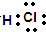 ;
;(3)C和E分别形成的气态氢化物中最稳定的是H2O(填写氢化物的化学式)
(4)A最高价氧化物的水化物和B的最高价氧化物的水化物反应的化学方程为NaOH+Al(OH)3=NaAlO2+2H2O.
分析 根据各短周期元素在周期表中的相对位置可知,A为Na元素、B为Al元素、C为O元素、D为C元素、E为S元素、F为Cl元素、G为H元素,据此结合元素周期律知识进行解答.
解答 解:根据各元素的相对位置可知,A为Na元素、B为Al元素、C为O元素、D为C元素、E为S元素、F为Cl元素、G为H元素,
(1)D为C元素,名称为碳,
故答案为:碳;
(2)G和F形成化合物为HCl,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为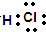 ,
,
故答案为: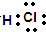 ;
;
(3)C为O元素、E为S元素,非金属性O>S,非金属性越强,对应氢化物的稳定性越强,则二者形成的气态氢化物中最稳定的是H2O,
故答案为:H2O;
(4)A最高价氧化物的水化物为NaOH,B的最高价氧化物的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠和水,反应的化学方程为:NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确元素周期表结构、元素周期律的内容为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍.则X、Y、Z三种元素,可能的组合是( )
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
7.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2、H2O2 | B. | C2H4、CH4 | C. | C60、C2H4 | D. | NH3、HCl |
4.短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )
| A. | 原子序数A>B | B. | 电子总数A->B2+ | C. | 离子半径A->B2+ | D. | 原子半径A>B |
8.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯(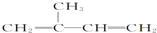 )与等物质的量的H2发生加成反应 )与等物质的量的H2发生加成反应 | |
| B. | 2-甲基-2-氯丁烷与NaOH乙醇溶液共热发生消去反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
5.下列叙述不正确的是( )
| A. | 淀粉、纤维素、油脂都属于高分子化合物 | |
| B. | 有甜味的物质不一定属于糖类 | |
| C. | 天然蛋白质水解的最终产物均为氨基酸 | |
| D. | 油脂水解得到的醇是丙三醇 |
6.下列配合物的配位数是6的是( )
| A. | K2[Co(SCN)4] | B. | Fe(SCN)3 | C. | Na3[AlF6] | D. | [Cu(NH3)4]Cl2 |
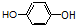 酚类;
酚类; 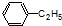 烃(或芳香烃);
烃(或芳香烃);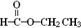 酯(或酯类);
酯(或酯类); 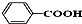 酸类(或芳香酸).
酸类(或芳香酸).