题目内容
2.在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是( )| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |
分析 A.pH=5的CH3COOH溶液稀释100倍,pH接近7,仍为酸性;
B.c(H+)=0.05mol/L×2=0.1mol/L,c(OH-)=0.1mol/L,等体积混合,n(H+)=n(OH-),为中性;
C.pH=2的盐酸中c(H+)=0.01mol/L,pH=12的氨水中c(NH3.H2O)>0.01mol/L;
D.pH=1的H2SO4中c(H+)=0.1mol/L,0.10mol/L 的Ba(OH)2溶液中c(OH-)=0.1mol/L×2=0.2mol/L.
解答 解:A.pH=5的CH3COOH溶液稀释100倍,pH接近7,仍为酸性,则c(H+)略小于1×10-7mol/L,故A不选;
B.c(H+)=0.05mol/L×2=0.1mol/L,c(OH-)=0.1mol/L,等体积混合,n(H+)=n(OH-),为中性,则c(H+)一定等于1×10-7mol/L,故B选;
C.pH=2的盐酸中c(H+)=0.01mol/L,pH=12的氨水中c(NH3.H2O)>0.01mol/L,等体积混合时碱过量,则溶液显碱性,c(H+)小于1×10-7mol/L,故C不选;
D.pH=1的H2SO4中c(H+)=0.1mol/L,0.10mol/L 的Ba(OH)2溶液中c(OH-)=0.1mol/L×2=0.2mol/L,则溶液显碱性,c(H+)小于1×10-7mol/L,故D不选;
故选B.
点评 本题考查酸碱混合的计算,为高频考点,把握pH与浓度的换算、酸碱混合的过量判断为解答的关键,侧重分析与计算能力的考查,注意常温时pH=7为中性,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
10.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恢复到电解前的浓度和pH,则电解过程中转移的电子数为( )
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
17.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
7.有关明矾净水原理的探究.
(1)提出问题:明矾在水溶液中能全部离解成自由移动的钾离子、铝离子和硫酸根离子,明矾的净水原理是什么?是谁在起作用?
(2)猜想与假设:明矾溶于水生成的胶状物与铝离子有关,即明矾净水是铝离子的作用.
(3)探究实验:设计实验、实验分析与论证.
完成表格:
(4)总结:由以上实验可知:明矾的净水作用与铝离子有关.
(1)提出问题:明矾在水溶液中能全部离解成自由移动的钾离子、铝离子和硫酸根离子,明矾的净水原理是什么?是谁在起作用?
(2)猜想与假设:明矾溶于水生成的胶状物与铝离子有关,即明矾净水是铝离子的作用.
(3)探究实验:设计实验、实验分析与论证.
完成表格:
| 实验步骤 | 实验现象 | 结论 |
| ①在蒸馏水中加少量明矾,搅拌静置 | 明矾全部溶解 | |
| ②在浑浊的天然水中加少量明矾,搅拌静置 | 有絮状沉淀生成,天然水变澄清 | |
| ③在浑浊的天然水中加少量硫酸,搅拌静置 | ||
| ④在浑浊的天然水中加少量硫酸钾,搅拌静置 | ||
| ⑤在浑浊的天然水中加氯化铝,搅拌静置 | 有絮状沉淀生成,天然水变 澄清 |
14.下列实验方法能达到相应实验目的是( )
| A. | 用BaCl2溶液鉴别Na2CO3和Na2SO4溶液 | |
| B. | 用淀粉溶液检验食盐中是否添加KIO3 | |
| C. | 用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl | |
| D. | 用溴水鉴别乙烯和二氧化硫两种气体 |
11.在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则 在此反应中,Y与R的化学式量之比为( )
| A. | 32:18 | B. | 16:11 | C. | 8:11 | D. | 16:9 |
12.下列各组物质中,不是按 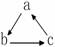 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391
mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391