题目内容
研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为 。
②已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131 kJ·mol-1,
则C(s)+CO2(g)=2CO(g) ΔH= 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391
mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391 .55 kJ·mol-1。则N
.55 kJ·mol-1。则N 2(g)+3H2(g)=2NH3(g) ΔH= 。
2(g)+3H2(g)=2NH3(g) ΔH= 。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,乙装置中电极A的名称 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中电极B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH= 。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
吸热反应C+CO2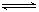 2CO反应速率为 ?1,放热反应N2+3H2
2CO反应速率为 ?1,放热反应N2+3H2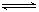 2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和
2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和 ?2的变化情况为? ?
?2的变化情况为? ?
A.同时增大  B.同时减小
B.同时减小
C.增大,减小 D.减小,增大
2.在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是( )
| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |


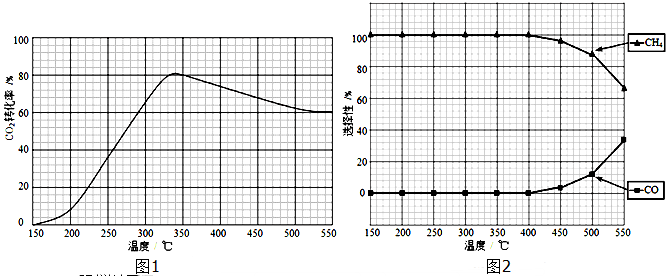
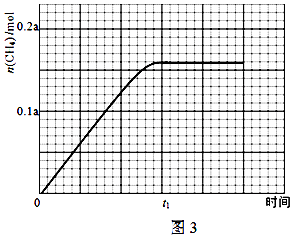
 误的是
误的是 液中溶质的物质的量浓度为2mol/L。
液中溶质的物质的量浓度为2mol/L。