题目内容
17.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
分析 A.燃烧热中水为液态;
B.合成氨为可逆反应,热化学方程式中为完全转化时的能量变化;
C.2gH2完全燃烧生成液态水,放出285.8 kJ热量,则2molH2完全燃烧生成液态水,放出热量为571.6kJ;
D.生成1mol水时放热为57.3 kJ,则生成2mol水时放出热为2×57.3 kJ,且生成硫酸钡放热.
解答 解:A.燃烧热中水为液态,则甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,故A错误;
B.合成氨为可逆反应,则1mol N2和3molH2置若完全反应生成NH3放热大于38.6kJ,热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ/mol,故B错误;
C.2gH2完全燃烧生成液态水,放出285.8 kJ热量,则2molH2完全燃烧生成液态水,放出热量为571.6kJ,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,故C正确;
D.生成1mol水时放热为57.3 kJ,则生成2mol水时放出热为2×57.3 kJ,且生成硫酸钡放热,则H2SO4和Ba(OH)2反应的反应热△H<2×(-57.3)kJ/mol,故D错误;
故选C.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、热化学方程式的书写方法、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表,若混合溶液中Ca2+、Al3+、Fe3+的浓度均为1.0×10-3mol•L-1,c(AsO43-)最大是( )
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| A. | 5.7×10-18 mol•L-1 | B. | 2.6×10-5mol•L-1 | ||
| C. | 1.6×10-13mol•L-1 | D. | 5.7×10-24mol•L-1 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NH4HCO3溶液中加入少量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 少量CO2通入苯酚钠溶液:2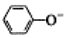 +CO2+H2O→2 +CO2+H2O→2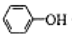 +CO32- +CO32- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
2.在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是( )
| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |
6.下列因果关系叙述正确的是( )
| A. | 浓硝酸中的HNO3见光会分解,因此有时在实验室看到的浓硝酸呈黄色 | |
| B. | SO2具有漂白性,因此可使溴水褪色 | |
| C. | Na的金属性比Cu强,因此可用Na与CuSO4溶液反应制取Cu | |
| D. | Fe在Cl2中燃烧生成FeCl3,因此在与其他非金属反应的产物中Fe也显+3价 |
7.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与 Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W 与 X、Y 既不同族也不同周期且 W 不为稀有气体元素; X、Y、Z 三种元素的族序数之和为16.下列说法正确的是( )
| A. | Q 与 W不能形成 10电子、14电子、18 电子分子 | |
| B. | Y 的最高价氧化物对应水化物的化学式只能表示为 H4YO4 | |
| C. | Y、Z、Q 分别与 X 化合,只能形成 AB2型化合物 | |
| D. | X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
