题目内容
9.把含有某一氯化物杂质的氯化钙5.55克溶于水后,与足量的硝酸银溶液反应,生成的氯化银沉淀15克,则该杂质可能是( )| A. | 氯化钠 | B. | 氯化钾 | C. | 氯化铜 | D. | 氯化铝 |
分析 假设5.55g全部为CaCl2,则生成AgCl为$\frac{5.55g}{111g/mol}$×2×143.5g/mol=14.35g<15g,故除杂氯化物中氯元素含量应大于CaCl2中氯元素含量,若全部为杂质,生成AgCl的质量应大于15g.
解答 解:假设5.55g全部为CaCl2,则生成AgCl为$\frac{5.55g}{111g/mol}$×2×143.5g/mol=14.35g<15g,故除杂氯化物中氯元素含量应大于CaCl2中氯元素含量,若全部为杂质,生成AgCl的质量应大于15g.
CaCl2中Ca、Cl质量之比为40:71,而NaCl中Na、Cl质量之比为46:71,KCl中K、Cl质量之比为78:71,CuCl2中Cu、Cl质量之比为64:71,AlCl3中Al、Cl质量之比为27:35.5×3=18:71,故AlCl3中氯元素含量大于CaCl2中氯元素含量,
假设5.55g全部为AlCl3,生成AgCl沉淀为$\frac{5.55g}{133.5g/mol}$×3×143.5g/mol≈17.9g>15g,符合题意,
故选:D.
点评 本题考查混合物的计算,题目难度中等,注意用端值法解答,属于易错题目,学生容易考虑氯元素含量大于氯化钙中氯元素含量,忽略若全部为杂质时生成AgCl的质量应大于15g.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
14.实验室用足量镁粉与一定量的盐酸反应来制取氢气,由于盐酸浓度太大,反应不易控制.为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质有( )
①NaOH固体 ②NH4Cl固体 ③CH3COONa溶液 ④K2SO4固体 ⑤加入适量水.
①NaOH固体 ②NH4Cl固体 ③CH3COONa溶液 ④K2SO4固体 ⑤加入适量水.
| A. | ③⑤ | B. | ②③ | C. | ②④ | D. | ①④ |
17.50mL 1mol/L氯化铝溶液中c(Cl-)相等的是( )
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
1.如图是元素周期表的一部分
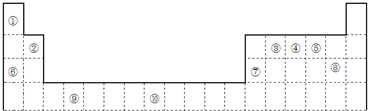
(1)元素⑩的次外层电子数为14个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是R和U.(填元素代号)
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.

(1)元素⑩的次外层电子数为14个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
18.科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,Al13、Al14的性质很像现行周期表中的某主族元素,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+.下列说法错误的是( )
| A. | Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ | |
| B. | Al13超原子中Al原子间是通过共价键结合的 | |
| C. | Al14、Al13性质与Al相似,都具有较强的还原性 | |
| D. | Al13和Al14互为同位素 |
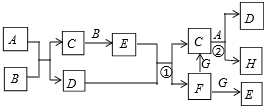 下列有关物质的转化关系如图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体.请回答下列问题:
下列有关物质的转化关系如图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体.请回答下列问题: .
.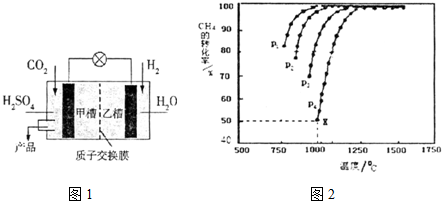 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.