题目内容
11.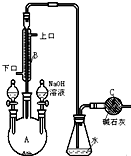 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题:(1)反应开始前已向仪器A中加入的固体药品是铁粉,则装在左侧分液漏斗中的液体药品是苯、液溴.
(2)写出实验室制溴苯的化学方程式
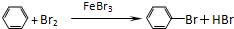 .
.(3)该反应装置中冷凝管B有上、下两个口,冷却水应从下口进入(填“上”或“下”).
(4)右侧分液漏斗中的物质在反应后加入A中(填“反应前”、“反应中”或“反应后”),用离子方程式表示其作用是Br2+2OH-=Br-+BrO-+H2O.
(5)C中碱石灰的作用是吸收多余HBr,防止污染空气.
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3; Br2+FeBr3=FeBr4-+Br+(不稳定);
 +Br+→[
+Br+→[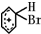 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)A.Br2B.FeBr3C.Br+D.FeBr4-.
分析 本题是依据苯的性质,用苯和溴为原料制备溴苯,并对反应后的混合物进行分离与提纯,得到纯净的溴苯,实验过程中为了防止溴的挥发,需要要安装冷凝装置,冷却水通常是低进高出,反应后的混合物通常用氢氧化钠溶液洗涤后再进行分液,因溴苯的密度比水大,分层后应在下层.
(1)该反应装置中仪器A的名称为三颈烧瓶,在溴化铁催化下,苯与液溴反应生成溴苯,装在左侧分液漏斗中的药品是反应物苯和液溴;
(2)苯与液溴反应生成溴苯的反应方程式;
(3)冷却水应从下口流入,上口流出,克服重力作用,流速较慢,可达到更好的冷凝效果;
(4)苯与液溴反应放热,溴易挥发;制备溴苯完成后,加入氢氧化钠溶液,利用溴和氢氧化钠反应,将溴苯中的溴除去;
(5)碱石灰吸收尾气,防止有毒气体逸出;
(6)催化剂的特征为反应前后质量和性质没有改变,据此判断.
解答 解:(1)该反应装置中仪器A的名称为三颈烧瓶,在溴化铁催化下,苯与液溴反应生成溴苯,反应开始前已向仪器A中加入的固体药品是铁粉,而装在左侧分液漏斗中的液体药品是苯、液溴,
故答案为:苯、液溴;
(2)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,反应的化学方程式为: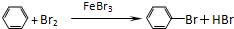 ,
,
故答案为: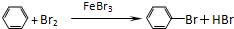 ;
;
(3)冷却水应从下口流入,上口流出,克服重力,与气体逆流,流速较慢,可达到更好的冷凝效果,
故答案为:下;
(4)由于反应放热,苯和液溴均易挥发,溴蒸气是一种红棕色的气体,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是使过量的Br2与 NaOH充分反应,可以将溴苯中的溴除去,即Br2+2NaOH=NaBr+NaBrO+H2O,离子反应为2 OH--+Br2═Br-+BrO-+H2O,
故答案为:反应后;Br2+2OH-=Br-+BrO-+H2O;
(5)C中碱石灰的作用是利用碱石灰吸收多余HBr,防止有毒气体逸出,污染环境,
故答案为:吸收多余HBr,防止污染空气;
(6)FeBr3、FeBr4-参与了反应,反应前后质量和性质没有改变,是C6H6+Br2→C6H5Br+HBr中的催化剂,
故答案为:BD.
点评 本题考查了溴苯的制备,题目难度中等,侧重考查学生分析问题解决问题的能力,注意掌握苯的取代反应原理,明确反应的产物及HBr的化学性质是解答关键,相比于教材中的装置图,有所改进.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |




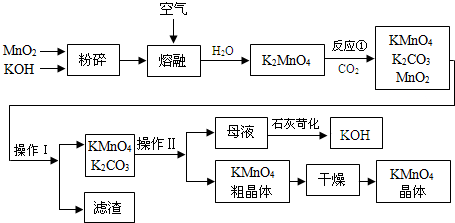

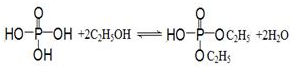 .
.
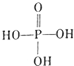
 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下: