题目内容
16.下列实验操作、现象及由此得出的结论均正确的是( )| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.不同的物质性质不同;
B.碳酸钡和硫酸钡都是白色沉淀;
C.红褐色沉淀为氢氧化铁沉淀;
D.庚烷密度小于水,紫红溶液应在上方.
解答 解:A.不同的物质性质不同,苏打和小苏打溶液与盐酸反应的速率不同,故A错误;
B.碳酸钡和硫酸钡都是白色沉淀,可能发生转化,故B错误;
C.红褐色沉淀为氢氧化铁沉淀,说明Fe2+被H2O2氧化为Fe3+,故C正确;
D.庚烷密度小于水,紫红溶液应在上方,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及化学反应速率、沉淀转化及氧化还原反应等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
6.下列反应的离子方程式正确的是( )
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
7.下列有关化学用语表示不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: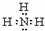 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: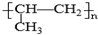 |
4.下列说法正确的是( )
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去可证明BaCl2溶液显酸性 | |
| B. | 根据盐溶液的酸碱性,将盐分成酸式盐、正盐和碱式盐 | |
| C. | 泡沫灭火器是利用硫酸铝溶液和碳酸钠溶液反应产生大量CO2和Al(OH)3灭火 | |
| D. | NH4F溶液中含有少量的HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
8.Na2CO3+CO2+H2O═2NaHCO3的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
5.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 分子数为NA的CO和C2H4混合气体的体积约为22.4 L | |
| B. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| C. | 用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA | |
| D. | 0.1 L 3.0 mol•L-1的NH4NO3溶液中含有NH${\;}_{4}^{+}$的数目为0.3NA |
3.某混合溶液中可能大量含有的离子如下表所示:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示.
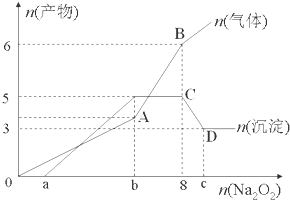
(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)a=1,b=7,c=9.
(3)写出下列离子方程式:
AB段2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
CD段Al(OH)3+OH-=AlO2-+2H2O.
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |

(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)a=1,b=7,c=9.
(3)写出下列离子方程式:
AB段2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
CD段Al(OH)3+OH-=AlO2-+2H2O.
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.