题目内容
3.某混合溶液中可能大量含有的离子如下表所示:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
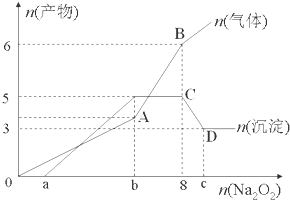
(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)a=1,b=7,c=9.
(3)写出下列离子方程式:
AB段2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
CD段Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)根据生成的沉淀总物质的量最大量为5mol、最终得到3mol可知,最终得到的沉淀为3mol氢氧化镁沉淀,溶解的2mol沉淀为氢氧化铝;根据气体的物质的量最后有增加可知,增加的气体为氨气,溶液中一定存在铵离子;根据开始加入过氧化钠时没有沉淀生成,说明原溶液中存在氢离子,根据题中数据计算出氢离子的物质的量;
(2)图象中所生成的气体和沉淀的量以及所加过氧化钠的量来计算各个点所对应的值;
(3)AB中过氧化钠与水反应、碱与铵根离子反应,CD中氢氧化铝与氢氧化钠溶液反应而导致沉淀减少,据此写出反应的离子方程式.
解答 解:(1)根据图象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含CO32-、AlO2-,并且含有镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol,根据元素守恒,所以含有铝离子的物质的量2mol;
加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以一定不含有氢氧根离子;图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,由于加入8mol过氧化钠时生成的沉淀达到最大量5mol,8mol过氧化钠会生成16mol氢氧化钠,而生成2mol氢氧化铝、3mol氢氧化镁、2mol氨气消耗的氢氧化钠为:2mol×3+3mol×2+2mol=14mol,所以有2mol氢氧化钠与氢离子反应,氢离子的物质的量为2mol;
并且物质的量为2mol,溶液中一定还含有阴离子,可能为氯离子或溴离子,钾离子不能确定是否存在,
根据电荷守恒:所以n(H+)+3n(Al3+)+n(NH4+)+2n(Mg2+)≤2n(SO42-),所以氯离子物质的量≥16mol,即:
| 离子种类 | H+ | Al3+ | NH4+ | Mg2+ | Br-或Cl- | |
| 物质的量(mol) | 2 | 2 | 2 | 3 | ≥16 |
故答案为:H+、Al3+、NH4+、Mg2+;2:2:2:3;OH-、CO32-、AlO2-;
(2)含有2mol的氢离子需要消耗氢氧化钠2mol,则需要1mol过氧化钠来生成,所以a=1,含有镁离子和铝离子一共5mol,所以消耗过氧化钠的量为5mol,在加上a=2mol,则b=7mol,氯离子的物质的量是2mol,所以氢氧化铝的物质的量是2mol,完全将氢氧化铝溶解,消耗1mol的氢氧化钠,即需要1mol的过氧化钠来生成,所以c=9mol,故答案为:1;7;9;
(3)AB段发生2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O,CD段氢氧化铝能够与氢氧化钠溶液反应,发生Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O;Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查常见的离子检验方法、离子方程式的书写,题目难度中等,注意掌握常见的离子检验方法,能够根据描述的反应现象判断存在的离子,注意掌握氢氧化铝的两性及反应的方程式.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量红棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的化学方程式是Al2O3+3H2SO4=2Al2(SO4)3+3H2O.
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+═1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
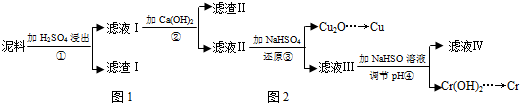
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.
(已知:Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
2Fe2++Cl2═2Fe3++2Cl-;
2Fe3++2I-═2Fe2++I2;
I2+SO2+2H2O═4H++2I-+SO42-.
| A. | Fe3+>I2>SO2>Cl2 | B. | Cl2>Fe3+>I2>SO2 | C. | I2>Cl2>Fe3+>SO2 | D. | Cl2>SO2>I2>Fe3+ |
 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.