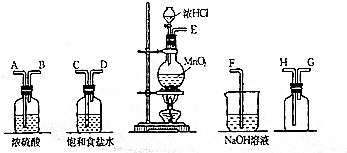
题目内容
6.下列反应的离子方程式正确的是( )| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
分析 A.2mol铝与氢氧化钠溶液反应生成3mol氢气,该反应不满足电子守恒;
B.氢氧化钙少量,反应生成碳酸钙沉淀、碳酸钠和水;
C.铁离子具有氧化性,能够氧化碘离子;
D.硫离子部分水解,溶液呈碱性,硫离子的水解分步进行,主要以第一步为主.
解答 解:A.用氢氧化钠溶液除去镁粉中的铝粉,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B.向碳酸氢钠溶液中加入少量氢氧化钙,反应生成碳酸钙沉淀、碳酸钠和水,反应离子方程式为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,故B正确;
C.氧化铁与HI发生氧化还原反应,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故C错误;
D.硫化钠溶液显碱性,硫离子的水解主要以第一步为主,其水解的离子方程式为:S2-+H2O?HS-+OH-,故D正确;
故选BD.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
16.500mL硝酸钾和硝酸铜的混合溶液中c(NO3-)═6.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况).下列说法正确的是( )
| A. | 原混合溶液中钾离子浓度为2 mol/L | |
| B. | 上述电解过程中共转移6摩尔电子 | |
| C. | 电解得到的铜的物质的量为0.5摩尔 | |
| D. | 电解后溶液中的pH=2 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | “84”消毒液中:K+、CO32-、Na+、I- | |
| B. | $\frac{K_W}{{C({H^+})}}$=1×10-13mol.L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 能使PH试纸显蓝色的溶液中:Na+、CH3COO-、Fe3+、SO42- | |
| D. | 通入足量的H2S后的溶液中:Al3+、Cu2+、SO42-、Cl- |
11.下列关于电解质溶液的叙述正确的是( )
| A. | 60℃时,NaCl溶液的pH<7,则溶液呈酸性 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 |
18.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.
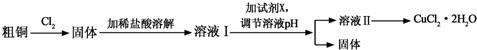
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
16.下列实验操作、现象及由此得出的结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题: