题目内容
1.过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%=$\frac{M(O)×n({H}_{2}{O}_{2})}{{m}_{样}}$×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1: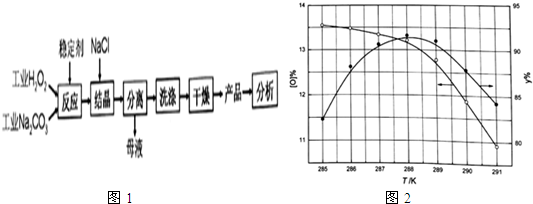
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式2(2Na2CO3•3H2O2 )$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+3O2↑+6H2O.
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是c(填字母).a.MnO2b.KI c.Na2SiO3d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如图1所示.要使产品达到优等品且产率超过90%合适的反应温度范围是286.8~288.5K.
③“结晶”时加入NaCl的目的是提高产量,其作用原理是增加钠离子浓度,促进过碳酸钠析出.
(3)“母液”中可循环利用的主要物质是NaCl.
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L-1硫酸溶解完全,立即用0.02000mol•L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mLo另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有H2O2、CO2.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响及其原因偏低,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解.
③该样品的活性氧含量为12.16%,表明该样品不是(填“是”或“不是”)
分析 制备过碳酸钠的工艺流程:2Na2CO3+2H2O2=2Na2CO3•3H2O2;双氧水稳定性差,易分解;因此向反应前的H2O2中加入稳定剂的作用是防止双氧水分解,因过碳酸钠易溶解于水,可利用盐析原理,结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,从溶液中过滤出固体后,需要洗涤沉淀,然后干燥得到产品.
(1)根据过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂可知,过碳酸钠受热分解生成碳酸钠、氧气、水;
(2)①双氧水可在MnO2、FeCl3催化作用下快速分解,与碘离子发生氧化还原反应,与硅酸钠不反应,可能用作“稳定剂”;
②根据图象分析,产品达到优等品且产率超过90%合适的反应温度范围来分析;
③因过碳酸钠易溶解于水,可利用盐析原理,过程中不断添加氯化钠晶体颗粒,抑制过碳酸钠溶解;
(3)“母液”中主要为氯化钠溶液,NaCl溶液又是抑制过碳酸钠溶解的原料;
(4)①过碳酸钠与硫酸反应,依据碳酸钠、过氧化氢和硫酸反应书写;
②工业盐酸常含微量Fe3+,为过氧化氢分解的催化剂;
③利用滴定原理2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2,建立关系式计算样品ω(活性氧),判断样品的优劣.
解答 解:(1)过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,受热分解生成碳酸钠、氧气、水,反应为:2(2Na2CO3•3H2O2 )$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+3O2↑+6H2O,
故答案为:2(2Na2CO3•3H2O2 )$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+3O2↑+6H2O;
(2)①过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,具有碳酸钠和过氧化氢的性质,过氧化氢易分解,MnO2、FeCl3为其催化剂,所以不能选,过氧化氢与碘离子发生氧化还原反应:2I-+H2O2+2H+=I2+2H2O,所以也不能选,过碳酸钠与硅酸钠不反应,可能用作“稳定剂”,故C选项符合,
故答案为:c;
②根据图象分析,温度为286.8~288.5K,产品达到优等品且产率超过90%,超过288.5K后,活性氧百分含量和产率均降低,所以最佳反应温度范围为286.8~288.5K,
故答案为:286.8~288.5K;
③结晶过程中加入氯化钠、搅拌,增加钠离子浓度,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,
故答案为:提高产量;增加钠离子浓度,促进过碳酸钠析出;
(3)结晶过程中加入氯化钠促进过碳酸钠析出,“母液”中主要为氯化钠溶液,NaCl溶液又是结晶过程中促进过碳酸钠析出的原料,故循环利用的物质是NaCl,
故答案为:NaCl;
(4)①过碳酸钠(2Na2CO3•3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,过碳酸钠与硫酸反应,为碳酸钠、过氧化氢和硫酸反应,所以产物为硫酸钠、过氧化氢、二氧化碳、水,
故答案为:H2O2、CO2;
②Fe3+为过氧化氢分解的催化剂,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解,测定时,若用工业盐酸代替硫酸,分析对测定结果偏低,
故答案为:偏低,工业盐酸常含微量Fe3+,溶解过程会催化H2O2分解;
③称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L-1硫酸溶解完全,立即用0.02000mol•L-1高锰酸钾标准溶液滴定,反应中MnO4-是氧化剂,H2O2是还原剂,氧化产物是O2;依据元素化合价变化,锰元素化合价从+7价变化为+2价,过氧化氢中的氧元素化合价从-1价变化为0价,根据电子守恒配平写出离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2三次滴定平均消耗KMnO4溶液26.56mL,依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;
2MnO4-~~~~~5H2O2;
2 5
(0.2526-0.0224)L×0.02mol/L 0.01216mol
过碳酸钠产品中活性氧含量([O]%=$\frac{M(O)×n({H}_{2}{O}_{2})}{{m}_{样}}$×100%=$\frac{16g/mol×0.01216mol}{0.16g}$=12.16%,13%以上为优等品,该产品不是,
故答案为:12.16;不是.
点评 本题考查了固体双氧水过碳酸钠(2Na2CO3•3H2O2)的制取方法及其性质,涉及内容较多,充分考查了学生的综合能力,明确实验目的及反应原理为解答关键,试题培养了学生的分析能力及化学实验能力,本题难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案| A. | 60℃时,NaCl溶液的pH<7,则溶液呈酸性 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 |
| A. | 常温常压下,46g NO2与N2O4的混合气体含有原子总数为3NA | |
| B. | 92g甲苯中含有碳碳双键数目为3 NA | |
| C. | 1 L 1 mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| D. | 标准状况下,2.24L Cl2与水反应转移的电子数目为0.1NA |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  量筒 | B. |  试管 | C. | 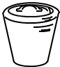 蒸发皿 | D. |  分液漏斗 |
| A. | 乙烯的结构简式:C2H4 | B. | 甲烷分子的球棍模型: | ||
| C. | NaCl的电子式: | D. | 氟离子的结构示意图: |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
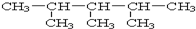 :2,3,4-三甲基戊烷.
:2,3,4-三甲基戊烷.