题目内容
7.下列有关化学用语表示不正确的是( )| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | NH3分子的电子式: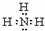 | ||
| C. | 铝原子的结构示意图: | D. | 聚丙烯的结构简式为: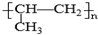 |
分析 A、写在元素符号的左上角的是质量数;
B、氨气中N原子和H原子间为共价键;
C、铝原子的核外有13个电子,核内有13个质子;
D、丙烯CH2=CHCH3经加聚后所得的为聚丙烯.
解答 解:A、写在元素符号的左上角的是质量数,而质量数等于质子数+中子数,故中子数为20的氯原子的符号为:3717Cl,故A错误;
B、氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故B正确;
,故B正确;
C、铝原子的核外有13个电子,核内有13个质子,核外的电子的排布2、8、3,故结构示意图为 ,故C正确;
,故C正确;
D、丙烯CH2=CHCH3经加聚后所得的为聚丙烯,加聚时碳碳双键断开,故所得的聚丙烯的结构简式为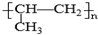 ,故D正确.
,故D正确.
故选A.
点评 本题考查了原子的表示方法、电子式的书写和原子结构示意图以及聚合物结构简式的书写,难度不大,注意基础的掌握.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
18.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.
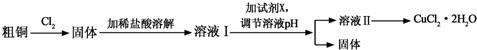
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
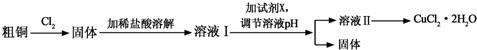
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)向0.1mol•L-1的CuCl2溶液中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:H2S+Cu2+=CuS↓+2H+.
若KSP[CuS]=1.2×10-36,则生成沉淀时需要S2-的浓度为1.2×10-35mol•L-1.
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉溶液,达到滴定终点时,溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,46g NO2与N2O4的混合气体含有原子总数为3NA | |
| B. | 92g甲苯中含有碳碳双键数目为3 NA | |
| C. | 1 L 1 mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| D. | 标准状况下,2.24L Cl2与水反应转移的电子数目为0.1NA |
19.下列结论正确的是( )
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,则金刚石比石墨稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀醋酸恰好完全反应,放出的热量为28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则碳的燃烧热等于110.5 kJ•mol-1 |
16.下列实验操作、现象及由此得出的结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
17.25℃,两种酸的电离平衡常数如下表.
实验室常用饱和NaHCO3溶液除去CO2中少量的SO2,请写出SO2和NaHCO3溶液反应的主要离子方程式SO2+HCO3-=HSO3-+CO2.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题: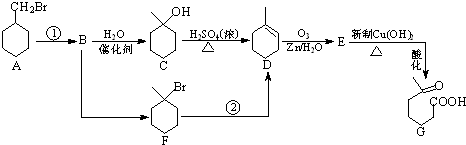
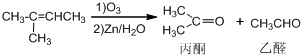
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃(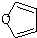 )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为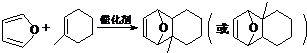 .
.