题目内容
3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
| B | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| D | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
分析 影响化学反应速率的主要因素是物质的本身性质,对于同一个化学反应,反应物浓度越大,温度越高,反应速率越大,注意硝酸与金属反应不生成氢气.
解答 解:活泼性Mg>Fe,则Mg反应较快,硝酸与金属反应不生成氢气,D中氢离子浓度最大,且温度较高,则反应速率最大.
故选D.
点评 本题考查化学反应速率的影响因素,难度不大,注意金属的活泼性强弱,为影响反应速率的主要因素,易错点为A,注意硝酸与金属反应不生成氢气.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.在氨水与NH4HCO3混合溶液中滴入FeCl2溶液,不可能发生反应的离子方程式是( )
| A. | Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+ | |
| B. | Fe2++NH3•H2O+HCO3-═FeCO3↓+NH4++H20 | |
| C. | Fe2++2HCO3-═Fe(OH)2↓+2CO2↑ | |
| D. | 2Fe2++HCO3-+3NH3•H2O═Fe2(OH)2CO3↓+3NH4++H2O |
14.科学家最近在-100℃的低温下合成了一种结构简式为 的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )
的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )
 的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )
的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | X中碳原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使酸性高锰酸钾溶液褪色 |
11. 请回答下列问题.
请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为c>a>b;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
 请回答下列问题.
请回答下列问题.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
18.一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g)?2NH3 (g)测得0s到10s内,C(H2)减小了0.75mol/L,下列说法正确的是( )
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
8.表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型).
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始产生白色沉淀,然后白色沉淀消失.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
12.根据表中7种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ② | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | ⑦①可形成离子化合物 | |
| B. | 元素②⑥形成的化合物具有两性 | |
| C. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| D. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 |
13.下列方程式书写正确的是( )
| A. | 乙醇与金属钠反应产生氢气:CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| B. | 苯与浓硫酸、浓硝酸的混合溶液共热制硝基苯: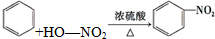 | |
| C. | 乙酸与乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2BrCH2Br |