题目内容
17.下列物质之间的相互关系不正确的是( )| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | O2和O3互为同素异形体 | ||
| C. | H、D、T互为同位素 | D. | 干冰和冰为同一种物质 |
分析 A.非金属性越强,对应最高价氧化物的水化物酸性越强;
B.同种元素的不同单质,互为同素异形体;
C.质子数相同,中子数不同的原子,互为同位素;
D.干冰为固体二氧化碳,冰为H2O.
解答 解:A.非金属性Cl>S>P>Si,对应最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4>H2SiO3,故A正确;
B.同种元素的不同单质,互为同素异形体,则O2和O3互为同素异形体,故B正确;
C.质子数相同,中子数不同的原子,互为同位素,则H、D、T互为同位素,故C正确;
D.干冰为固体二氧化碳,冰为H2O,二者为不同的物质,故D错误;
故选D.
点评 本题考查较综合,涉及元素周期律、同位素、同素异形体的判断等,把握元素的位置、元素周期律、基本概念的辨析等为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
8.有机物甲可氧化生成羧酸,也可以还原生成醇.由甲生成的羧酸与醇在一定条件下反应可以生成化合物乙,其分子式为C2H4O2.下列叙述中正确的是( )
| A. | 甲分子中氢的质量分数为40% | |
| B. | 甲和由甲生成的羧酸与醇三者均可溶于水 | |
| C. | 甲在常温常压下为无色液体 | |
| D. | 乙和甲的最简式不同 |
5.将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池.已知.通入CH4的一极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;另一极通入O2.下列叙述不正确的是( )
| A. | 通人CH4的电极为负极 | |
| B. | 正极发生氧化反应 | |
| C. | 燃料电池工作时,溶液中的OH-向负极移动 | |
| D. | 该电池使用一段时间后应补充KOH |
12.下列反应的离子方程式正确的是( )
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O═Fe(OH)3↓+3 H+ | |
| B. | 用小苏打治疗胃酸过多:HCO3ˉ+H+═CO2↑+H2O | |
| C. | 实验室用浓盐酸与MnO2反应制氯气:2Cl-+MnO2+2H+=Mn2++2H2O+Cl2↑ | |
| D. | 用FeCl3溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
2.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
6.X、Y、Z是短周期的三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为16,原子序数之和为38,则X、Y、Z的元素符号为( )
| A. | Na、K、Ca | B. | N、P、S | C. | F、Cl、S | D. | O、S、Cl |
7.“水”电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 每生成2mol Na2Mn5O10转移4mol电子 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
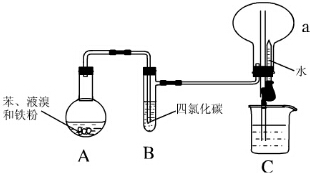 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
. 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.