题目内容
2.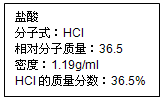 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是BD
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(2)容量瓶上需标有以下五项中的ACE
A.温度 B.浓度 C.规格 D.压强 E.刻度线
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol•L-1的稀盐酸.
将下列操作填写完整;
A.用量筒准确量取浓盐酸①16.8mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀.
B.将已冷却的盐酸沿玻璃棒注入 ②500mL容量瓶中.
C.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡.
D.继续往容量瓶内小心加水,直到液面接近刻度线下1-2cm处.
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切.
F.将容量瓶盖紧,颠倒摇匀.
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”、“无影响”).
①用量筒量取浓盐酸时俯视观察凹液面偏小
②溶液注入容量瓶前没有冷却至室温偏大.
分析 (1)根据该物理量是否有溶液的体积有关判断;
(2)依据容量瓶构造解答;
(3)依据配制溶液体积选择合适规格容量瓶;依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要用盐酸体积;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)A.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故A不选;
B.溶液具有均一性,浓度与体积无关,故B选;
C.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故c不选;
D.溶液的密度与溶液的体积无关,故D选;
故选:BD;
(2)容量瓶为配制一定物质的量浓度、一定体积溶液的专用仪器,标有:温度、容积、刻度线,
故选:ACE;
(3)配制480mL物质的量浓度为0.400mol•L-1的稀盐酸,应选择500mL容量瓶,浓盐酸的物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:11.9mol/L×V=0.4mol/L×500mL,解得V=16.8mL;
故答案为:A.16.8;
B.500mL容量瓶;
(4)①用量筒量取浓盐酸时俯视观察凹液面偏小,导致量取浓盐酸体积偏小,溶质的物质的量偏小,溶液浓度偏小;
故答案为:偏小;
②溶液注入容量瓶前没有冷却至室温,冷却后溶液体积偏小,溶液浓度偏大;
故答案为:偏大.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案| A. | 取25 g CuSO4•5H2O溶于1 L水中 | |
| B. | 取16 g CuSO4•5H2O溶于少量水中,再稀释至1 L | |
| C. | 取16 g无水CuSO4溶于1 L水中 | |
| D. | 取25 g CuSO4•5H2O溶于水配成1 L溶液 |
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
(1)写出A的化学式CaCl2
(2)写出B与D反应的离子方程式:CO32-+2H+=CO2↑+H2O
(3)说明A与B不发生反应的理由:不满足离子反应的条件.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦缩聚.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤⑦ | D. | ②③④⑤⑥ |
| A. | 溴水、FeCl3溶液 | B. | 溴水、酸性KMnO4溶液 | ||
| C. | 溴水、Na2CO3溶液 | D. | FeCl3溶液、酸性KMnO4溶液 |
| A. | N2 | B. | Cl2 | C. | H2 | D. | CO2 |
| A. | CaCO3 | B. | NaOH | C. | H2SO4 | D. | CuO |
 反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示: