题目内容
11.四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,就如何检验这四种溶液分别解答下列各题.在四支试管中分别取四种溶液各1mL(只取一次溶液),做下列实验.
(1)在四支试管中分别滴入(写化学式,下同)稀硝酸,可检验出的物质是Na2CO3溶液,离子方程式是CO32-+2H+=H2O+CO2↑.
(2)在剩余三支试管中分别滴入Ba(NO3)2溶液,可检验出的物质是Na2SO4溶液,离子方程式是Ba2++SO42-=BaSO4↓.
(3)在剩余两支试管中分别滴入AgNO3溶液,可检验出的物质是NaCl溶液,离子方程式是Ag++Cl-=AgCl↓.
分析 NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,加盐酸检验碳酸钠会干扰NaCl检验,则加硝酸检验碳酸钠,剩余三种物质中与硝酸钡反应生成沉淀的为Na2SO4溶液,最后对剩余的两种物质中与硝酸银反应生成白色沉淀的为NaCl,则另一无现象的为NaNO3溶液,以此来解答.
解答 解:(1)加盐酸检验碳酸钠会干扰NaCl检验,则加稀硝酸检验碳酸钠,即出现气泡的为Na2CO3溶液,发生的离子反应为CO32-+2H+=H2O+CO2↑,
故答案为:稀硝酸;Na2CO3溶液;CO32-+2H+=H2O+CO2↑;
(2)剩余三支试管中分别滴入Ba(NO3)2溶液,出现白色沉淀的是Na2SO4溶液,发生的离子反应为Ba2++SO42-=BaSO4↓,
故答案为:Ba(NO3)2溶液;Na2SO4溶液;Ba2++SO42-=BaSO4↓;
(3)剩余两支试管中分别滴入AgNO3溶液,出现白色沉淀的是NaCl溶液,而三次实验中都没有明显现象的是NaNO3溶液,涉及离子反应为Ag++Cl-=AgCl↓,
故答案为:AgNO3溶液;NaCl溶液;Ag++Cl-=AgCl↓.
点评 本题考查物质的检验实验方案的设计,为高频考点,把握物质的性质及检验时发生的反应、现象为解答的关键,注意检验物质中不能引入干扰离子,题目难度不大.

练习册系列答案
相关题目
1.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
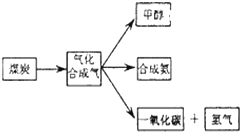
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min),
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.

(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
19.取100mL 0.3mol•L-1和300mL 0.25mol•L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度为( )
| A. | 0.42mol•L-1 | B. | 0.21mol•L-1 | C. | 0.56mol•L-1 | D. | 0.24mol•L-1 |
6.下列说法中正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
16.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将 100mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | 通常状况下,0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| C. | 常温常压下,2.4g金属镁变成镁离子时,失去的电子数为0.1NA | |
| D. | 标准状况下,22.4L由N2和N2O组成的混合气体中,所含N原子的个数为2NA |
3.根据题意回答问题:
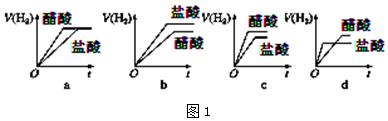
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).
(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.
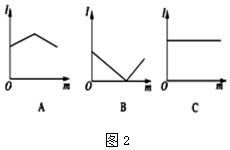
①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
①HSO3-的电离平衡常数表达式为:$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).

(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.

①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
1.在反应2F2+2H2O═4HF+O2中,H2O是( )
| A. | 氧化剂 | B. | 还原剂 | C. | 溶剂 | D. | 催化剂 |
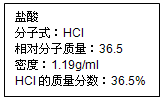 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.