题目内容
14.标准状况下,质量相等的下列物质中体积最大的是( )| A. | N2 | B. | Cl2 | C. | H2 | D. | CO2 |
分析 标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}$×Vm确定相同质量的不同气体体积大小.
解答 解:氮气的摩尔质量是28g/mol、氯气的摩尔质量是71g/mol、氢气的摩尔质量是2g/mol、二氧化碳的摩尔质量是44g/mol,标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}$×Vm知,相同质量的不同气体,其体积与摩尔质量成反比,摩尔质量最小的气体其体积最大,所以气体体积最大的是氢气,
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下,气体体积与其摩尔质量的关系是解本题关键,灵活运用公式来分析解答,题目难度不大.

练习册系列答案
相关题目
7.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 金属的焰色反应 | C. | 液溴的气化 | D. | 漂白粉久置失效 |
9.某同学用某种粗盐进行提纯实验,步骤见图.
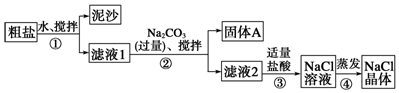
请回答下列问题:
(1)步骤①和②的操作名称是过滤.
(2)步骤③判断加入盐酸“适量”的方法是滴加盐酸至无气泡产生为止;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止溶液飞溅,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:

请回答下列问题:
(1)步骤①和②的操作名称是过滤.
(2)步骤③判断加入盐酸“适量”的方法是滴加盐酸至无气泡产生为止;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止溶液飞溅,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | Ⅰ有气泡放出,澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入Ⅱ稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | Ⅲ猜想Ⅱ不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,Ⅳ滴入BaCl2溶液和稀HNO3溶液 | Ⅴ有白色沉淀且不溶于稀HNO3 | 猜想Ⅲ成立 |
19.取100mL 0.3mol•L-1和300mL 0.25mol•L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度为( )
| A. | 0.42mol•L-1 | B. | 0.21mol•L-1 | C. | 0.56mol•L-1 | D. | 0.24mol•L-1 |
6.下列说法中正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
3.根据题意回答问题:
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
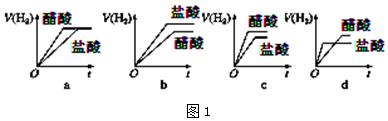
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).
(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.
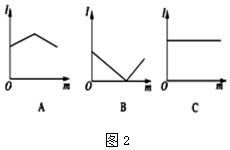
①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
①HSO3-的电离平衡常数表达式为:$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).

(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.

①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
4.下列两种粒子的半径大小排列正确的是( )
| A. | Na>O | B. | Na+>O2- | C. | Mg>Na | D. | Mg2+>Na+ |
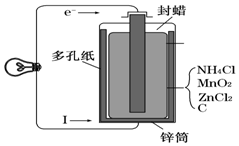 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.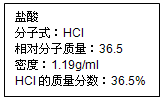 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: