题目内容
15.配制0.1mol/L CuSO4溶液1L,正确的操作是( )| A. | 取25 g CuSO4•5H2O溶于1 L水中 | |
| B. | 取16 g CuSO4•5H2O溶于少量水中,再稀释至1 L | |
| C. | 取16 g无水CuSO4溶于1 L水中 | |
| D. | 取25 g CuSO4•5H2O溶于水配成1 L溶液 |
分析 配制0.1mol/L CuSO4溶液1L,结合n=cVM计算,溶液的体积为1L,以此来解答.
解答 解:A.1L水为溶剂的体积,不能计算浓度,故A不选;
B.16 g CuSO4•5H2O,溶质物质的量为$\frac{16g}{250g/mol}$<0.1mol,故B不选;
C.1L水为溶剂的体积,不能计算浓度,故C不选;
D.取25 g CuSO4•5H2O溶于水配成1 L溶液,则$\frac{\frac{25g}{250g/mol}}{1L}$=0.1mol/L,故D选;
故选D.
点评 本题考查配制一定浓度的溶液,为高频考点,把握质量、浓度、物质的量的关系为解答的关键,侧重分析与实验能力的考查,注意溶液体积的判断,题目难度不大.

练习册系列答案
相关题目
5.能正确表示下列反应的离子方程式的是( )
| A. | 石灰石跟盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与盐酸的反应OH-+H+═H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
10.在常温下发生下列反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
| A. | 溶液中可能发生反应Z2+2A2+=2A3++2Z- | |
| B. | Z2在①③反应中作还原剂 | |
| C. | 氧化性强弱顺序为XO4->Z2>B2>A3+ | |
| D. | X2+是XO4-的还原产物 |
20.(1)表中有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).
根据该表回答问题:
①第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
②第Ⅱ组物质中,跟第Ⅰ组所有物质都不能发生反应的是NaOH,该物质能与第Ⅲ组中所有物质发生反应,其离子反应方程式分别为:Cu2++2OH-=Cu(OH)2↓,OH-+H+=H2O,OH-+HCO3-=CO32-+H2O.
( 2)现有下列几种物质
①铜 ②稀硫酸 ③氯化氢 ④氯气 ⑤空气 ⑥二氧化碳 ⑦盐酸 ⑧氯化钠 ⑨熔融的硝酸钾 ⑩硫酸钡
其中,属于混合物的有②⑤⑦,( 填序号,下同)属于电解质的有③⑧⑨⑩,属于非电解质的有⑥.
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | NaHCO3 |
①第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
②第Ⅱ组物质中,跟第Ⅰ组所有物质都不能发生反应的是NaOH,该物质能与第Ⅲ组中所有物质发生反应,其离子反应方程式分别为:Cu2++2OH-=Cu(OH)2↓,OH-+H+=H2O,OH-+HCO3-=CO32-+H2O.
( 2)现有下列几种物质
①铜 ②稀硫酸 ③氯化氢 ④氯气 ⑤空气 ⑥二氧化碳 ⑦盐酸 ⑧氯化钠 ⑨熔融的硝酸钾 ⑩硫酸钡
其中,属于混合物的有②⑤⑦,( 填序号,下同)属于电解质的有③⑧⑨⑩,属于非电解质的有⑥.
7.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 金属的焰色反应 | C. | 液溴的气化 | D. | 漂白粉久置失效 |
1.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
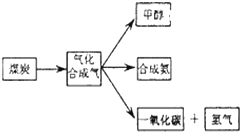
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min),
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.

(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
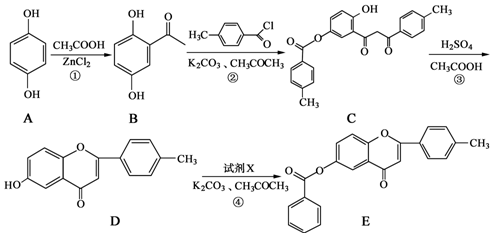
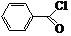 .
.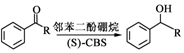 .
.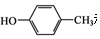 和CH3COOH为原料制备
和CH3COOH为原料制备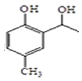 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).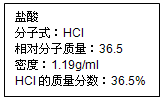 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: