题目内容
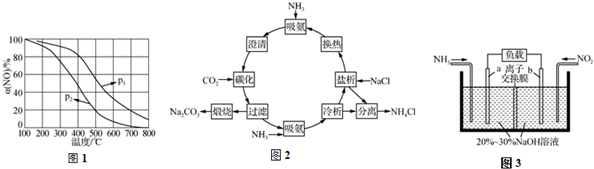
8. 用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 电解过程中,Ca2+向阳极移动 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱是Pb电极 |
分析 根据图知,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2 $\frac{\underline{\;一定条件下\;}}{\;}$Ti+2CaO,“+”接线柱应连接原电池正极,电解过程中,电解质中阳离子向阴极移动、阴离子向阳极移动,据此分析解答.
解答 解:A.电解过程中,电解质中阳离子向阴极移动、阴离子向阳极移动,所以Ca2+向阴极移动,故A错误;
B.根据图知,阳极上生成二氧化碳,则阳极反应式为C+2O2--4e-═CO2↑,故B正确;
C.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变,故C错误;
D.“+”表示原电池正极,所以“+”接线柱应连接原电池正极,即PbO2极,故D错误;
故选B.
点评 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,易错选项是C,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各组离子,在指定的条件下一定能大量共存的是( )
| A. | NH4Fe(SO4)2的溶液中:H+、Mg2+、Br-、NO3- | |
| B. | 含有大量HCO3-的溶液:NH4+、Ca2+、AlO2-、I- | |
| C. | 浓度为3%的H2O2溶液:H+、Fe2+、C1-、SO42- | |
| D. | c(S2-)=0.1mo1.L-1的溶液中:Na+、NH4+、ClO-、SO42- |
19.下列实验能够达到实验目的是( )
| A. | 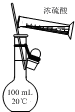 用如图装置配制100 mL 0.1 mol/L的硫酸 | |
| B. |  用如图装置提取碘水中碘 | |
| C. |  用如图装置制取少量乙烯气体 | |
| D. | 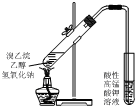 用如图装置验证溴乙烷发生消去反应 |
3.已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价绝对值与W元素最高正价相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R的最高价氧化物对应的水化物两两反应均生成盐和水.下列说法正确的是( )
| A. | 原子半径由大到小的顺序:Z、W、Y | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
17.某合作学习小组讨论辨析以下说法,其中正确的是( )
①碘酒和酸雨都是混合物;
②汽油和柴油都是纯净物;
③冰和干冰既是纯净物又是氧化物;
④铝合金和目前流通的硬币都是合金;
⑤盐酸和硫酸既是化合物又是酸;
⑥纯碱和烧碱都是碱;
⑦豆浆和牛奶都是胶体.
①碘酒和酸雨都是混合物;
②汽油和柴油都是纯净物;
③冰和干冰既是纯净物又是氧化物;
④铝合金和目前流通的硬币都是合金;
⑤盐酸和硫酸既是化合物又是酸;
⑥纯碱和烧碱都是碱;
⑦豆浆和牛奶都是胶体.
| A. | ①③④⑦ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①②③④ |
5.TK时,向2.0L恒容器密闭容器中充入0.10molCOCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后到达平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022mol•L-1,则反应的△H<0 | |
| B. | 反应在前2s的平均速率v(CO)=0.015mol•L-1•S-1 | |
| C. | 保持其他条件不变,起始向容器中充入0.12molCOCl2和0.060molCl2、0.060 molCO,反应达到平衡前的速率:v正<v逆 | |
| D. | 保持其他条件不变,起始向容器中充入0.10molCl2和0.08molCO,达到平衡时,Cl2的转化小于60% |
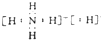 .
.