题目内容
5. 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,Fe3+的电子排布式为1s22s22p63s23p63d6.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
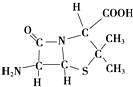
(3)氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有C、N、O、S.
分析 (1)体心立方晶胞中每个Fe原子周围有8个Fe原子,Fe属于26号元素,3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+;
(2)根据价层电子对互斥理论判断NO3-的空间构型;原子个数相等价电子数相等的微粒是等电子体,正负电荷重心重合的分子是非极性分子;
(3)根据价层电子对互斥理论确定原子杂化方式.
解答 解:(1)心立方晶胞中每个Fe原子周围有8个Fe原子,故晶胞中该原子的配位数为8,Fe属于26号元素,电子排布式为1s22s22p63s23p63d64s2,3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d6,
故答案为:8;1s22s22p63s23p63d6;
(2)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,与N03-互为等电子体的一种非极性分子有:BF3[SO3( g)、BBr3等],
故答案为:平面正三角形;BF3[SO3( g)、BBr3等];
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,
故答案为:C、N、O、S.
点评 本题考查较综合,涉及核外电子排布式的书写、等电子体、杂化方式的判断等知识,这些都是学习重点,高频考点,掌握相关知识是解答关键,题目难度中等.

练习册系列答案
相关题目
8.下列每小题最后的物质是要制取的,其中合理的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
13.下列化合物中能量最低的是( )
| A. | HF | B. | H20 | C. | H2S | D. | CH4 |
20.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铜片、银片,FeCl3溶液 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、石墨棒,稀硫酸 |
10.一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,关于检验该信息素中官能团的试剂和顺序,下列说法正确的是( )
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
17.下列说法错误的是( )
| A. | 加入催化剂一定能加快反应速率 | B. | 温度越高反应速率也越大 | ||
| C. | 固体颗粒大小也会影响反应速率 | D. | 反应速率主要由反应物性质决定 |
14.100mL 6mol•L-1 H2SO4跟锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采用下列措施( )
| A. | 加碳酸钠(固体) | B. | 加水 | C. | 加金属钠 | D. | 加浓硝酸 |
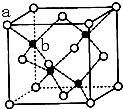 A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb
A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb .
.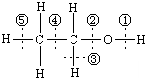 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: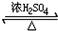 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,