题目内容
8.下列每小题最后的物质是要制取的,其中合理的是( )| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
分析 A.氧化铝是两性氧化物和盐酸反应生成氯化铝溶液,氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,蒸发溶液氯化氢挥发促进水解得到水解产物氢氧化铝;
B.铜和稀硫酸不发生反应;
C.铁和氯气反应生成氯化铁,氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,氢氧化铁受热分解生成氧化铁;
D.镁在空气中燃烧生成氧化镁,氧化镁和盐酸反应生成氯化镁溶液,氯化镁水解生成氢氧化镁和氯化氢,蒸发溶液氯化氢挥发,促进水解,生成水解产物氢氧化镁;
解答 解:A.氧化铝是两性氧化物和盐酸反应生成氯化铝溶液,Al2O3+6HCl=2AlCl3+3H2O,氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,AlCl3+3H2O?Al(OH)3+3HCl,蒸发溶液氯化氢挥发促进水解得到水解产物氢氧化铝,最后一步不能得到氯化铝,故A错误;
B.铜和稀硫酸不发生反应,第一步不能完成,故B错误;
C.铁和氯气反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,FeCl3+3NaOH=Fe(OH)3+3NaCl,氢氧化铁受热分解生成氧化铁,2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,能实现各步反应,故C正确;
D.镁在空气中燃烧生成氧化镁,2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,氧化镁和盐酸反应生成氯化镁溶液,MgO+2HCl=MgCl2+H2O,氯化镁水解生成氢氧化镁和氯化氢,MgCl2+2H2O?Mg(OH)2+2HCl,蒸发溶液氯化氢挥发,促进水解,生成水解产物氢氧化镁,最后一步不能得到,故D错误;
故选C.
点评 本题考查了物质性质、物质反应产物判断、盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 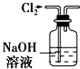 用如图所示装置除去Cl2中含有的少量HCl | |
| B. |  如图所示为石油分馏 | |
| C. | 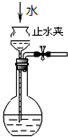 如图所示为检查装置气密性 | |
| D. | 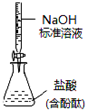 如图所示为测定未知盐酸的浓度 |
| A. | 氟离子的结构示意图: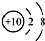 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 溴化铵的电子式: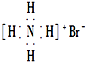 | |
| D. | 质子数为53,中子数为78的碘原子:53131 I |
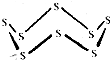 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
(2)如果研究催化剂对化学反应速率的影响,使用实验②和④(用实验序号表示,下同);如果研究温度对化学反应速率的影响,使用实验②和⑤.
(3)若表中Vx=5ml,可利用实验①和实验③研究反应物浓度对化学反应速率的影响,且t1<t3(填“>”、“<”或“=”),理由是在其他条件相同时,实验①的反应物浓度大于实验③的反应物浓度,所以实验①的反应速率大于实验③的反应速率.
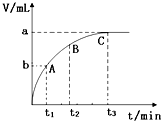
(4)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则0-t1、t1-t2、t2-t3三段所表示的反应速率最慢的是t2-t3.
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图甲所示.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
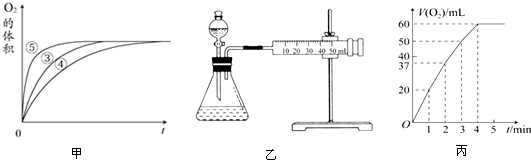
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图乙所示的实验装置进行实验.
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示.解释反应速率变化的原因:随着反应的进行,浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是C(填序号).
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的原子质量 | |
| C. | 某种元素的平均相对原子质量 | |
| D. | 某种元素的平均相对原子质量的近似值 |
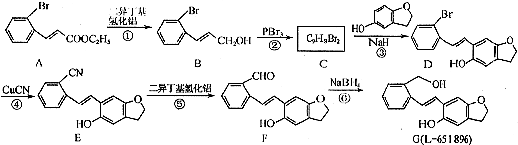
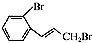 .
. (只写一种).
(只写一种).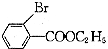 为原料制备二氢异苯并呋喃(结构简式如图
为原料制备二氢异苯并呋喃(结构简式如图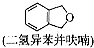 )的合成路线流程图(无机试剂可任选).
)的合成路线流程图(无机试剂可任选).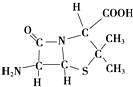 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.