题目内容
14.100mL 6mol•L-1 H2SO4跟锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采用下列措施( )| A. | 加碳酸钠(固体) | B. | 加水 | C. | 加金属钠 | D. | 加浓硝酸 |
分析 为了减缓100mL 6mol•L-1 H2SO4跟锌粉反应的速率,可降低氢离子浓度、反应温度,但又不影响生成氢气的总量,则氢离子的总物质的量不变,据此进行解答.
解答 解:A.加入碳酸钠,消耗硫酸,浓度降低,反应速率减小,但生成氢气的总量减小,故A错误;
B.加入水,氢离子浓度降低,则反应速率减小,但生成氢气的总量不变,故B正确;
C.加入金属钠,钠能够与水反应,导致生成氢气的总量增加,故C错误;
D.加入浓硝酸,生成NO气体,影响生成氢气的总量,故D错误;
故选B.
点评 本题考查化学反应速率的影响因素,侧重于基础知识的考查,题目难度不大,明确题目要求为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.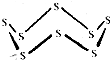 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
6.在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的原子质量 | |
| C. | 某种元素的平均相对原子质量 | |
| D. | 某种元素的平均相对原子质量的近似值 |
3.实验室常用H2O2制取O2,下列说法不正确的是( )
| A. | H2O2分子中含有极性键和非极性键 | |
| B. | 向其溶液加入少量MnO2和FeCl3等能加快反应 | |
| C. | H2O2分子中所有原子都达8电子结构 | |
| D. | 该反应中H2O2是氧化剂也是还原剂 |
 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.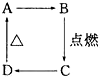 如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.
如图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸.C为无色无味的气体,能使石灰水变浑浊,D为一种酸,请填写以下空白.