题目内容
20.为探讨化学平衡与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-?2Fe2++I2”反应中 Fe3+和 Fe2+的相互转化.实验如图1,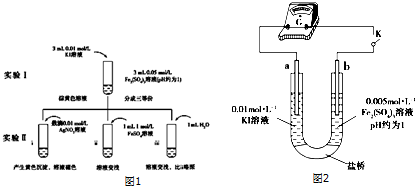
(1)ⅲ是ⅱ的对比实验,目的是排除ⅱ中溶液稀释对颜色的变化造成的影响.
(2)ⅰ和ⅱ的颜色变化表明平衡逆向移动,Fe2+向 Fe3+转化.用化学平衡移动原理解释ⅰ的原因:Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动.
(3)根据氧化还原反应的规律,该同学推测ⅰ中 Fe2+向 Fe3+转化的原因:外加 Ag+使 c(I-)降低,导致 I-的还原性弱于 Fe2+,用如图2装置(a,b 均为石墨电极)进行实验验证.
①K 闭合时,指针偏转,b 作正极.
②当指针归零(反应达到平衡)后,向 U 型管左管中滴加 0.01mol/L AgNO3溶液,产生的现象证实了其推测.该现象除了产生淡黄色沉淀,另一现象是左管出现黄色沉淀,指针向左偏转.
(4)按照(3)的原理,该同学用上图装置进行实验,证实ⅱ中 Fe2+向 Fe3+转化的原因.其操作是向U型管右管中滴加1mol/LFeSO4溶液.
(5)实验Ⅰ中,还原性:I->Fe2+;而实验Ⅱ中,还原性 Fe2+>I-.将(2)和(3)、(4)作对比,得出结
论是该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动.
分析 (1)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响;
(2)加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(3)①K闭合时,指针向右偏转,可知b极Fe3+得到电子,作正极;
②②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,可知I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(4)与(3)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加1mol/L FeSO4溶液;
(5)将(3)和(4)、(5)作对比,可知氧化性、还原性与浓度有关.
解答 解:(1)由实验iii和实验ii的对比可知,对比实验的目的是为了排除有ii中水造成溶液中离子浓度改变的影响,故答案为:溶液稀释对颜色的变化;
(2)加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动,可知Fe2+向Fe3+转化,故答案为:Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(3)①K闭合时,指针向右偏转,右侧为正极,可知b极Fe3+得到电子,则b作正极,故答案为:正;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动,指针向左偏转,也可证明推测Fe2+向Fe3+转化,故答案为:左管出现黄色沉淀,指针向左偏转;
(4)与(3)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加1mol/L FeSO4溶液,Fe2+向Fe3+转化,
故答案为:向U型管右管中滴加1mol/L FeSO4溶液;
(5)将(3)和(4)、(5)作对比,得出的结论是该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动,
故答案为:该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动.
点评 本题为2015年北京高考真题,有删减,侧重原电池、氧化还原反应及平衡移动的综合考查,把握平衡移动的影响因素及物质的性质为解答的关键,对分析与实验能力要求较高,题目难度较大.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
( )
| A. | $\frac{{{ρ_1}+{ρ_2}}}{2}$ | B. | $\frac{30.0%+20.0%}{2}$ | C. | 小于25.0% | D. | 大于25.0% |
| A. | NaHCO3溶液中加入稀 HCl:CO23-+2H+═H2O+CO2↑ | |
| B. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO24-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 苯酚钠溶液中通入少量 CO2气体:2C6H5O-+CO2+H2O→2C6H5OH+CO23- | |
| D. | 用惰性电极电解氯化铝溶液:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
| A. | 放电时,蓄电池由化学能转化为电能 | |
| B. | 充放电时,溶液的导电能力变化不大 | |
| C. | 放电时的负极反应式为 Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为 Pb2++4OH-+2e-═PbO2+2H2O |
 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2.0mol/L.
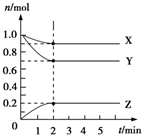
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题:
(5)反应开始至2min,Y的平均反应速率0.03mol/(L•min).
(6)分析有关数据,写出X、Y、Z的反应方程式X(g)+3Y(g)?2Z(g).
| A. | KCl固体 | B. | K2SO4溶液 | C. | 铁粉 | D. | KNO3溶液 |
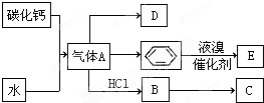 C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;D的最简式为CH2.
;D的最简式为CH2.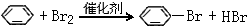 ,其反应类型为取代反应.
,其反应类型为取代反应.