题目内容
9.一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响氢气的量,可向其中加入( )| A. | KCl固体 | B. | K2SO4溶液 | C. | 铁粉 | D. | KNO3溶液 |
分析 硫酸过量,则生成氢气由锌决定,为了减慢反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变锌的物质的量,以此解答该题.
解答 解:A.加入氯化钾,溶液中H+的浓度不会变化,反应速率几乎无变化,故A错误;
B.加入K2SO4溶液,相当于加入水,会使得溶液中H+的浓度减小,反应速率减慢,故B正确;
C.加入铁粉,生成更多的氢气,不符合题意,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,可与锌反应生成NO而不生成氢气,故D错误.
故选B.
点评 本题考查影响反应速率的因素,为高考常考考点,注意硫酸过量,生成氢气由锌决定,把握浓度、温度、原电池对反应速率的影响即可解答,易错点为D,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列离子方程式书写正确的是( )
| A. | 固体氯化铵和消石灰混合加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| B. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| C. | 铜与稀硝酸:Cu+4H++2NO3-═Cu2++NO2↑+2H2O | |
| D. | 向氨水中通入过量的二氧化碳:NH3•H2O+CO2═NH4++HCO3- |
18.由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时的如厕难题.新型小分子团水,具有饮用量少、渗透力强、生物利用度高、在人体内储留时间长、排放量少的特点.一次饮用125mL小分子团水,可维持人体6小时正常需水量.下列关于小分子团水的说法正确的是( )
| A. | 水分子的化学性质改变 | B. | 水分子间结构、物理性质改变 | ||
| C. | 水分子间作用力减小 | D. | 水分子中氧氢键长缩短 |
19.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
| A. | 比丁烷更易液化 | B. | 光照能够发生取代反应 | ||
| C. | 分子中的碳原子不在一条直线上 | D. | 是石油分馏的一种产品 |
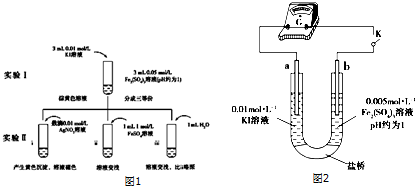
 ,属于加聚反应(填反应类型).
,属于加聚反应(填反应类型).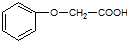 发生酯化反应的产物.
发生酯化反应的产物. 、
、 等.
等.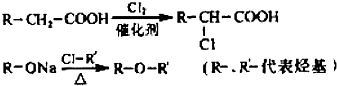
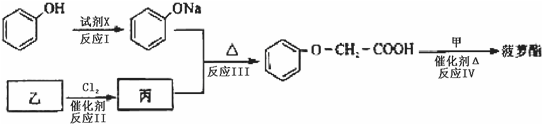
 .
.