题目内容
12.为测定由CO、NH3、CO2、H2组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量).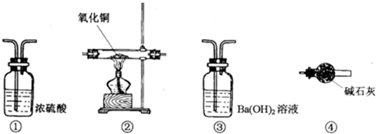
已知存在下列反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
请回答:
Ⅰ、混合气体通过各装置的顺序依次是④→(①)→②→③;
Ⅱ、写出装置③中有关反应的离子方程式CO2+Ba2++2OH-=BaCO3↓+H2O;
Ⅲ、装置③和④的位置不可互换,其原因是先用碱石灰直接测定出原有的二氧化碳,若装置③和④的位置互换会造成NH3体积测定时的巨大误差.
分析 为测定由CO、NH3、CO2、H2组成的混合气体中各成分的体积分数,先通过装置④吸收二氧化碳气体测定二氧化碳的质量,由于NH3可以与CuO反应,影响测定结果,所以用浓硫酸除去,通过装置①中浓硫酸吸收氨气测定氨气质量,再通过装置②CO和H2都能还原氧化铜分别生成二氧化碳和水,通过装置③吸收生成的二氧化碳得到一氧化碳的量,最后利用CO、NH3、CO2计算氢气体积分数,
(1)根据每种气体检验所需要的装置,根据流程判断顺序;
(2)通过装置③的气体为CO2,根据反应物和生成物写出离子方程式;
(3)若装置③和④的位置互换,则通过装置③时,会带出水蒸气,被吸收氨气的装置②吸收,影响结果.
解答 解:(1)由于CO通过②时,会转化为CO2,应先检验CO2,并除尽,应先通过碱石灰,由于NH3可以与CuO反应,影响测定结果,所以用浓硫酸除去,CO和H2,都有还原性,通过灼热的CuO,CO被氧化为,用③吸收,所以,顺序为:④①②③,
故答案为:④;②;③;
(2)通过装置③的气体为CO2,可以与Ba(OH)2发生离子反应,写出离子方程式为:CO2+Ba2++2OH-=BaCO3↓+H2O,
故答案为:CO2+Ba2++2OH-=BaCO3↓+H2O;
(3)先用碱石灰直接测定出原有的二氧化碳,若装置③和④的位置互换,则通过装置③时,会带出水蒸气,被吸收氨气的装置②吸收,则造成巨大误差,
故答案为:先用碱石灰直接测定出原有的二氧化碳,若装置③和④的位置互换会造成NH3体积测定时的巨大误差.
点评 本题考查了物质组成和含量的测定方法、气体检验、气体检验的试剂和顺序,注意气体检验干扰防止产生较大误差,掌握基础是解题关键,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
2.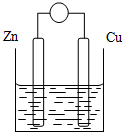 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
填表:
【注意】①电解质溶液的pH增大
②在同一个电池中两极反应时,“失去电子数”与“得到电子数”要相同.
(3)原电池工作时电子、离子运动方向.
①外电路(导线):电子从负极经导线流向正极
②原电池内电解质溶液中:阴离子流向负极,阳离子流向正极.
 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.填表:
| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
②在同一个电池中两极反应时,“失去电子数”与“得到电子数”要相同.
(3)原电池工作时电子、离子运动方向.
①外电路(导线):电子从负极经导线流向正极
②原电池内电解质溶液中:阴离子流向负极,阳离子流向正极.
2.下列化学实验事实及其解释或结论都正确的是( )
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀:AgCl(S)+I-?AgI(S)+Cl- | |
| C. | 吸滤瓶中的溶液应从吸滤瓶的支管口处倒出 | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |

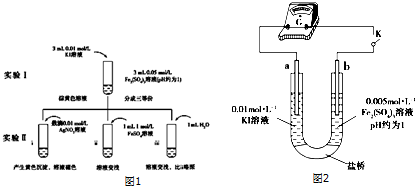
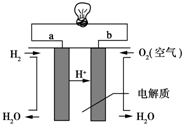 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格. ,属于加聚反应(填反应类型).
,属于加聚反应(填反应类型).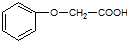 发生酯化反应的产物.
发生酯化反应的产物. 、
、 等.
等.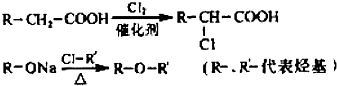
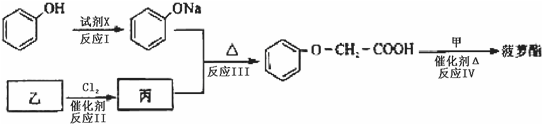
 .
.