题目内容
有A、B、C、D四种元素,它们的原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1mol C单质跟水反应放出11.2L(标准状况)B气体单质,1mol D单质跟水反应产生11.2L(标准状况)A气体,此时D转化成具有氖原子核外电子层结构的离子.试判断:
(1)这四种元素的名称:A 、B 、C 、D .
(2)C原子的结构示意图: ,D离子的结构示意图: .
(3)这四种元素的原子半径由小到大的顺序为 .
(4)写出C单质与水反应的化学方程式: .
(5)写出D单质与水反应的离子方程式: .
(1)这四种元素的名称:A
(2)C原子的结构示意图:
(3)这四种元素的原子半径由小到大的顺序为
(4)写出C单质与水反应的化学方程式:
(5)写出D单质与水反应的离子方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)A、B、C、D四种元素,它们的原子序数依次增大,1molD单质跟水反应产生11.2L(标准状况下)A气体单质,此时D转化成具有氖原子核外电子层结构的离子,则D为钠元素,A为氢元素,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1molC单质跟水反应产生11.2L(标准状况下)B气体单质,则B为氧元素,C为氟元素;
(2)C为氟元素,原子序数为9,D为钠元素,原子序数为11,钠离子核外为10个电子;
(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大;
(4)C和水反应生成氢氟酸和氧气;
(5)钠和水反应生成氢氧化钠和氢气;
(2)C为氟元素,原子序数为9,D为钠元素,原子序数为11,钠离子核外为10个电子;
(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大;
(4)C和水反应生成氢氟酸和氧气;
(5)钠和水反应生成氢氧化钠和氢气;
解答:
解:(1)A、B、C、D四种元素,它们的原子序数依次增大,1molD单质跟水反应产生11.2L(标准状况下)A气体单质,此时D转化成具有氖原子核外电子层结构的离子,则D为钠元素,A为氢元素,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1molC单质跟水反应产生11.2L(标准状况下)B气体单质,则B为氧元素,C为氟元素,综上所述:A为氢,B为氧,C为氟,D为钠,
故答案为:氢;氧;氟;钠;
(2)C为F,F为9号元素,原子核中有9个质子,核外9个电子,其原子结构示意图为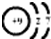 ,D为Na,钠离子的结构示意图为
,D为Na,钠离子的结构示意图为 ,
,
故答案为: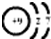 ;
; ;
;
(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,所以H、O、F、Na四种元素的原子半径由小到大的顺序为H<F<O<Na,
故答案为:H<F<O<Na;
(4)C为氟元素,F2与水反应的化学方程式为:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(5)D为钠,钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑.
故答案为:氢;氧;氟;钠;
(2)C为F,F为9号元素,原子核中有9个质子,核外9个电子,其原子结构示意图为
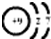 ,D为Na,钠离子的结构示意图为
,D为Na,钠离子的结构示意图为 ,
,故答案为:
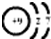 ;
; ;
;(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,所以H、O、F、Na四种元素的原子半径由小到大的顺序为H<F<O<Na,
故答案为:H<F<O<Na;
(4)C为氟元素,F2与水反应的化学方程式为:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(5)D为钠,钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑.
点评:本题主要考查了离子结构示意图、元素周期律的应用、化学方程式书写等知识点,题目中等难度,解题的关键在于元素推断.

练习册系列答案
相关题目
化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列操作正确的是( )
| A、给试管内的液体加热,可使试管口对准自己,不能对准别人 |
| B、用规格为50 mL的量筒量取2.5 mL的液体 |
| C、称量NaOH固体的质量时,把NaOH固体直接放到天平左边的托盘上 |
| D、实验室制取氧气时,先检查装置的气密性,然后再加药品 |
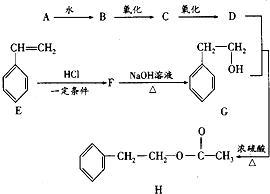 乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精.天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成.如图是一种合成路线(部分反应物和条件省略).
乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精.天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成.如图是一种合成路线(部分反应物和条件省略).