题目内容
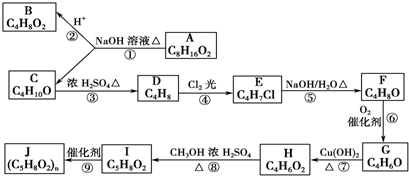
原子序数依次增大的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物.其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两种氧化物.
(1)W元素在元素周期表的位置为 ,用电子式表示其气态氢化物的形成过程 .
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是 .
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性.设计实验,验证该氧化物具有还原性,其操作方法是 .
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO.则反应中氧化剂与还原剂的物质的量的比为 .
(1)W元素在元素周期表的位置为
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性.设计实验,验证该氧化物具有还原性,其操作方法是
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO.则反应中氧化剂与还原剂的物质的量的比为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是原子序数依次增大的,故Y的原子序数大于W的,所以W是氮元素,Y是硫元素;
X的氧化物既可以和强酸、亦可以和强碱反应,原子序数大于N,小于S,所以X是铝元素;
Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,Z的原子序数大于S的,所以Z是铜元素,据此解答各小题即可.
X的氧化物既可以和强酸、亦可以和强碱反应,原子序数大于N,小于S,所以X是铝元素;
Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,Z的原子序数大于S的,所以Z是铜元素,据此解答各小题即可.
解答:
解:导致酸雨的主要物质是二氧化氮和二氧化硫,且W、X、Y、Z是原子序数依次增大的,故Y的原子序数大于W的,所以W是氮元素,Y是硫元素;
X的氧化物既可以和强酸、亦可以和强碱反应,原子序数大于N,小于S,所以X是铝元素;
Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,Z的原子序数大于S的,所以Z是铜元素,
综上所述:W为氮,X为铝,Y为硫,Z为铜,
(1)W为氮,N处于第二周期第VA族,氨气为共价化合物,其形成过程为3H?+ →
→ ,
,
故答案为:第二周期第VA族;3H?+ →
→ ;
;
(2)铝离子水解生成氢氧化铝胶体,由于胶体颗粒较大,能吸附水中悬浮杂质,离子反应方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(3)二氧化硫具有还原性,能与高锰酸钾溶液反应使其褪色,方法是:将SO2气体通入酸性高锰酸钾溶液中,若高锰酸钾溶液褪色,说明SO2具有还原性,
故答案为:将SO2气体通入酸性高锰酸钾溶液中,若高锰酸钾溶液褪色,说明SO2具有还原性;
(4)Cu2O被稀HNO3氧化为Cu2+,NO3-被还原为NO,同时生成H2O,其反应的离子方程式为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,据此反应方程式可知:氧化剂与还原剂的物质的量之比为2:3,故答案为:2:3.
X的氧化物既可以和强酸、亦可以和强碱反应,原子序数大于N,小于S,所以X是铝元素;
Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,Z的原子序数大于S的,所以Z是铜元素,
综上所述:W为氮,X为铝,Y为硫,Z为铜,
(1)W为氮,N处于第二周期第VA族,氨气为共价化合物,其形成过程为3H?+
 →
→ ,
,故答案为:第二周期第VA族;3H?+
 →
→ ;
;(2)铝离子水解生成氢氧化铝胶体,由于胶体颗粒较大,能吸附水中悬浮杂质,离子反应方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(3)二氧化硫具有还原性,能与高锰酸钾溶液反应使其褪色,方法是:将SO2气体通入酸性高锰酸钾溶液中,若高锰酸钾溶液褪色,说明SO2具有还原性,
故答案为:将SO2气体通入酸性高锰酸钾溶液中,若高锰酸钾溶液褪色,说明SO2具有还原性;
(4)Cu2O被稀HNO3氧化为Cu2+,NO3-被还原为NO,同时生成H2O,其反应的离子方程式为:3Cu2O+14H++2NO3-═6Cu2++2NO↑+7H2O,据此反应方程式可知:氧化剂与还原剂的物质的量之比为2:3,故答案为:2:3.
点评:本题主要考查的是元素的推断与元素化合物的知识,难度不大,注意总结归纳.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
只用一种试剂来鉴别氢氧化钾、氢氧化钙和稀盐酸三种溶液,这试剂是( )
| A、氯化钡溶液 | B、碳酸钠溶液 |
| C、酚酞试液 | D、硝酸银溶液 |
 二氧化硫是我国允许使用的食品漂白剂,二氧化硫的漂白作用是由于它能跟某些有色物质发生加成反应而生成不稳定的无色物质.这种无色物质容易又分解而使有色物质恢复原来的颜色.为避免食品中二氧化硫残留量超过标准要求,从而引起食用者的不良反应,漂白剂使用时要严格控制使用量及二氧化硫残留量.?
二氧化硫是我国允许使用的食品漂白剂,二氧化硫的漂白作用是由于它能跟某些有色物质发生加成反应而生成不稳定的无色物质.这种无色物质容易又分解而使有色物质恢复原来的颜色.为避免食品中二氧化硫残留量超过标准要求,从而引起食用者的不良反应,漂白剂使用时要严格控制使用量及二氧化硫残留量.?