题目内容
4.对如下反应:CO(气)+2H2(气)?CH3OH(气)(正反应为放热反应),为提高单位时间内CH3OH的产量,工厂应控制的反应条件是( )| A. | 高温、低压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 低温、高压、催化剂 |
分析 为提高单位时间内CH3OH的产量,改变条件可以促使化学平衡正向移动即可.
解答 解:升高温度,可以让化学平衡逆向移动,甲醇的产量降低,速率加快,降低温度,可以让化学平衡正向移动,甲醇的产量升高,速率减慢,所以为保证催化剂的催化活性,提高产物的产率,采用适宜温度;升高压强,可以让化学平衡正向移动,甲醇的产量增大,加入催化剂,可以使速率加快,故选B.
点评 本题是一道化学化工生产实际和化学原理结合的题目,注意知识的迁移应用是关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
12.从能量的变化和反应的快慢等角度研究反应具有重要意义.
(1)已知反应2H2+O2=H2O为放热反应,如图能正确表示该反应中能量变化的是A.
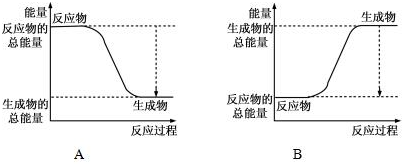
从断键和成键的角度分析上述反应中能量的变化.
化学键的键能如表:则生成1mol水可以放出热量242kJ
(2)原电池可将化学能转化为电能.将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
(1)已知反应2H2+O2=H2O为放热反应,如图能正确表示该反应中能量变化的是A.

从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
9.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是( )
| A. | 增加C的量 | |
| B. | 加催化剂 | |
| C. | 保持体积不变,充入氮气使体系压强增大 | |
| D. | 保持压强不变,充入氮气使容器体积增大 |
16.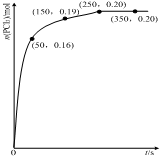 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| B. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
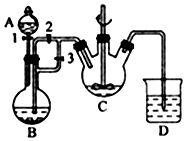
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.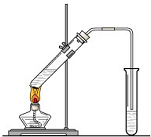 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题: