题目内容
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| B. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
分析 A.依据n=$\frac{m}{M}$结合三氧化硫结构组成解答;
B.溶液体积未知;
C.常温常压下,Vm≠22.4mol/L;
D.气体摩尔体积使用对象为气体.
解答 解:A.1个三氧化硫含有3个氧原子,常温常压下,80g SO3含有的氧原子数为$\frac{80g}{80g/mol}$×3×NA=3NA,故A正确;
B.溶液体积未知,无法计算微粒个数,故B错误;
C.常温常压下,Vm≠22.4mol/L,无法计算氢气的物质的量,故C错误;
D.标况下水是液体,不能使用气体摩尔体积,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
4.对如下反应:CO(气)+2H2(气)?CH3OH(气)(正反应为放热反应),为提高单位时间内CH3OH的产量,工厂应控制的反应条件是( )
| A. | 高温、低压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 低温、高压、催化剂 |
5.下列物质存放在烧杯中一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸.
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸.
| A. | ①⑥ | B. | ②③⑤ | C. | ③⑤ | D. | ②③④ |
2.某溶液中发生反应:A?2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )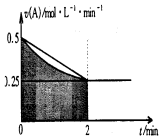

| A. | 0-2min,速率不断减少的主要原因是A的浓度减少 | |
| B. | 反应开始前2min,C的浓度增加量等于A的浓度减少量 | |
| C. | 至2min时,A的物质的量减小值可能是0.5mol | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
9.下列说法中错误的是( )
| A. | CO2、SO3都是极性分子 | |
| B. | KF是离子化合物,HF为共价化合物 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
19.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一 | |
| B. | 氧化铝陶瓷是一种超硬物质,能抵抗冷热冲击,是一种高压钠灯灯管的良好材料 | |
| C. | 空气污染指数的项目包括:二氧化硫、二氧化氮和可吸入颗粒物等 | |
| D. | 为了防止食物腐败,可以向食品中加入大量的NaNO2 |
3.下列A、B、C、D四种分离物质的方法,从其分离的原理来看,有一种与其他三种不同.这种方法是( )
| A. | 用蒸发水分的方法使海水中的盐析出 | |
| B. | 用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇 | |
| C. | 用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来 | |
| D. | 用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去 |