题目内容
13.常温时,下列叙述正确的是( )| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
分析 A、加水稀释促进醋酸电离,溶液中氢离子浓度、醋酸根离子浓度减小,根据水的离子积常数确定氢氧根离子浓度变化;
B、利用c(碱)=$\frac{c(酸)V(酸)}{V(碱)}$来进行误差分析;
C、pH均为11的NaOH和NH3•H2O溶液中,氢氧根离子的浓度相同;
D、硫酸是强电解质,溶液中完全电离,醋酸是弱电解质,部分电离.
解答 解:A、加水稀释能促进醋酸电离,溶液中C(H+)、C(CH3COO-)、C(CH3COOH)减小,温度不变,Kw不变,则C(OH-)增大,故A错误;
B、读取盐酸体积时,开始仰视读数,读数偏小,滴定结束时俯视读数,读数偏大,则差偏小,即消耗酸的体积偏小,所以c(碱)偏低,故B正确;
C、pH均为11的NaOH和NH3•H2O溶液中,氢氧根离子的浓度相同,所以对水的电离抑制程度相同,所以水的电离程度相同,故C错误;
D、c(H+)=10-PH,硫酸是强电解质,氢离子完全电离出来;醋酸是弱电解质,氢离子部分电离,c(醋酸)>c(H+),所以醋酸消耗的氢氧化钠比硫酸多,故D错误.
故选B.
点评 本题考查了弱酸、弱碱的电离和中和滴定,学生要清楚pH均为11的NaOH和NH3•H2O溶液中氢氧根离子的浓度相同,所以水的电离程度相同,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列有机物在核磁共振氢谱上有两组峰的是( )
| A. | 甲酸乙酯 | B. | 2-甲基丙烯酸乙酯 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 2-氯-2-甲基丙醛 |
4.在298K、1.01×105Pa下,将32g SO2通入750mL 1mol•L-1 KOH溶液中充分反应.测得反应放出x kJ的热量.已知在该条件下,1mol SO2通入1L 2mol•L-1KOH溶液中充分反应放出y kJ的热量.则 SO2与KOH溶液反应生成 KHSO3的热化学方程式正确的是( )
| A. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(4x-y) kJ•mol | |
| B. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2x-y) kJ•mol-1 | |
| C. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2y-x) kJ•mol | |
| D. | 2SO2(g)+2KOH (l)═2KHSO3 (l)△H=-(8x-2y) kJ•mol-1 |
1.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.下列说法错误的是( )
| A. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| B. | 该反应中反应物的总能量低于生成物的总能量 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
8.关于胶体,下列说法正确的是( )
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
18.在常温常压下,10ml硫化氢气体和一定体积的氧气混合点燃,反应后恢复至原状态,余下15mL气体,则反应前氧气的体积为( )
| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |
2.以下命题符合化学变化规律的是( )
| A. | 金属铜制成纳米铜 | B. | 把水变成汽油 | ||
| C. | 热核聚变把氢原子变成氦原子 | D. | 干冰变成原子晶体 |
3.下列说法正确的是( )
| A. | 第2周期元素从左到右,最高正化合价从+1递增到+7 | |
| B. | 在周期表中的过渡元素中寻找半导体材料 | |
| C. | 元素周期表中元素的性质与元素在周期表中的位置有关 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
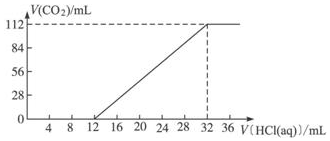 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.