题目内容
11.在所给条件下,一定能大量共存的微粒组是( )| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
分析 A.离子之间不发生任何反应;
B.发生氧化还原反应;
C.NO易与氧气反应;
D.氯气具有强氧化性,硫化氢具有强还原性.
解答 解:A.Fe3+与其它离子之间不发生任何反应,可大量共存,故A正确;
B.PH=1的溶液呈酸性,酸性条件下,Fe2+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.NO易与氧气反应,在空气中稳定存在,故C错误;
D.氯气具有强氧化性,硫化氢具有强还原性,二者发生氧化还原反应,不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点和常见题型,侧重元素化合物知识的综合理解和运用的考查,明确习题中的信息及离子之间的反应是解答本题的关键,注意发生的氧化还原反应,题目难度不大.

练习册系列答案
相关题目
1.化学与环境、科学、技术密切相关.下列有关说法中正确的是( )
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
2.下列说法正确的是( )
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
19.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g).达到平衡时,c(H2)=1mol•L-1,c(HI)=4mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
6.对于常温pH=2的醋酸溶液,下列叙述不正确的是( )
| A. | c(H+)=c(CH3CO0-) | |
| B. | 加水稀释时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈酸性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
3.某校研究性学习小组学习完卤族元素后,进行了如下实验探究.
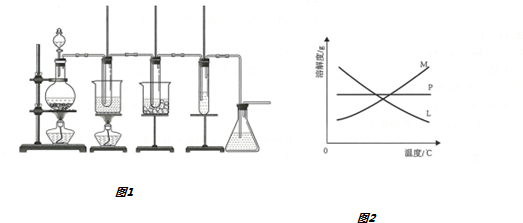
Ⅰ.在实验室用图1装置制取氯酸钾、次氯酸钠并探究氯水的性质
图1中:①为氯气发生装置;
②中试管里盛有15mL30%KOH溶液,并置于水浴中;
③中试管里盛有15mL8%NaOH溶液,并置于冰水浴中;
④中试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
回答下列问题
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填写编号字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同反应完毕经冷却后,②的试管中有大量晶体析出,图2中符合该晶体溶解度变化规律的曲线是M(填写编号字母);从②的试管中分离出该晶体的方法是过滤(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O
(4)实验中可观察到④的试管里溶液颜色发生了如下变化,请填写表中空白:
Ⅱ.在实验室用图3装置探究氯气的性质
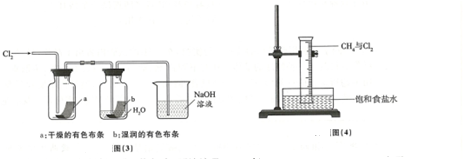
(5)将硫酸溶液滴入图3烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是Cl-+ClO-+2H+=Cl2+H2O;
(6)将图4装置放置在光亮的地方(日光不直接照射),一段时间后,观察到量筒内壁上有油状液滴生成,量筒内液面上升.油状液地的成分可能是CH2Cl2、CHCl3、CCl4 (写分子式);量筒内液面上升的原因是氯化氢极易溶于水,量筒中压强减小,液面上升.

Ⅰ.在实验室用图1装置制取氯酸钾、次氯酸钠并探究氯水的性质
图1中:①为氯气发生装置;
②中试管里盛有15mL30%KOH溶液,并置于水浴中;
③中试管里盛有15mL8%NaOH溶液,并置于冰水浴中;
④中试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
回答下列问题
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填写编号字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同反应完毕经冷却后,②的试管中有大量晶体析出,图2中符合该晶体溶解度变化规律的曲线是M(填写编号字母);从②的试管中分离出该晶体的方法是过滤(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O
(4)实验中可观察到④的试管里溶液颜色发生了如下变化,请填写表中空白:
| 实验现象 | 原因 |
| 溶液从初的紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊试液变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |

(5)将硫酸溶液滴入图3烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是Cl-+ClO-+2H+=Cl2+H2O;
(6)将图4装置放置在光亮的地方(日光不直接照射),一段时间后,观察到量筒内壁上有油状液滴生成,量筒内液面上升.油状液地的成分可能是CH2Cl2、CHCl3、CCl4 (写分子式);量筒内液面上升的原因是氯化氢极易溶于水,量筒中压强减小,液面上升.
10.某食品袋中有一个写着“干燥剂”的小纸袋,里面的物质主要成分是生石灰,对此“干燥剂”的说法正确的是( )
| A. | 此干燥剂为混合物 | |
| B. | 小纸袋中的物质可长期持续地做干燥剂 | |
| C. | 其中钙元素的存在形态为游离态 | |
| D. | 此干燥剂不能和盐酸反应 |
7.某研究性学习小组欲探究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,其速率最快的实验是5(填实验序号).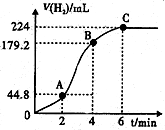
(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |

(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.